- Löslich
-
Die Löslichkeit eines Stoffes gibt an, in welchem Umfang ein Reinstoff in einem Lösungsmittel gelöst werden kann. Sie bezeichnet also die Eigenschaft eines Stoffes, sich unter homogener Verteilung (als Atome, Moleküle oder Ionen) mit dem Lösungsmittel zu vermischen. Meist ist das Lösungsmittel eine Flüssigkeit. Es gibt aber auch feste Lösungen, wie etwa Legierungen, Gläser, keramische Werkstoffe und dotierte Halbleiter. Bei der Lösung von Gasen in Flüssigkeiten bezeichnet der Begriff Löslichkeit einen Koeffizienten, der die im Diffusionsgleichgewicht mit dem Gasraum in der Flüssigkeit gelöste Gasmenge bezogen auf den Druck des Gases angibt.
Man unterscheidet die
- qualitative Löslichkeit (ist der Stoff in einem bestimmten Lösungsmittel in erkennbarem Maße löslich?) und die
- quantitative Löslichkeit (welche Stoffmenge kann im Einheitsvolumen eines bestimmten Lösungsmittels gelöst werden?).
Inhaltsverzeichnis
Qualitative Löslichkeit
 Nachweisreaktion über Löslichkeitsgrenzen: In der Ammoniumcarbonatgruppe des Kationentrenngangs fällt u.a. Calciumcarbonat als Niederschlag aus (Kalkpulver)
Nachweisreaktion über Löslichkeitsgrenzen: In der Ammoniumcarbonatgruppe des Kationentrenngangs fällt u.a. Calciumcarbonat als Niederschlag aus (Kalkpulver)Heute weiß man, dass es bei Temperaturen über dem absoluten Nullpunkt allein aus thermodynamischen Gründen (Entropie) für jeden Stoff in jedem anderen Stoff immer eine gewisse Löslichkeit geben muss. Die immer genauer werdenden Analysemethoden bestätigen das. Deshalb kann streng genommen eine Unterscheidung zwischen löslich und unlöslich nicht getroffen werden. Es handelt sich also um semiquantitative Feststellungen wie schwer löslich, begrenzt löslich oder unbegrenzt löslich ein Stoff in einem anderen ist.
Eine mögliche Einteilung der Löslichkeiten ist über die Menge an maximal gelöstem Stoff gegeben. Unter 0,1 mol/l gelöstem Stoff spricht man von schwerlöslich, zwischen 0,1 und 1 mol/l von mäßig löslich und bei Löslichkeiten von größer 1 mol/l von leicht löslich.[1]
In welchen Flüssigkeiten ein Feststoff gut löslich ist, hängt von den molekularen Eigenschaften des Stoffes und der Flüssigkeit ab. So sind salzartige Stoffe (Ionen-Verbindungen) fast nur in polaren Lösungsmitteln wie Wasser oder auch Fluorwasserstoff (HF) löslich. Viele lipophile, z. B. wachsartige, Stoffe sind dagegen nur in organischen Lösungsmitteln wie Benzin (einem „apolaren“ Lösungsmittel) nennenswert löslich. „Polar“ bedeutet in diesem Zusammenhang, dass die Moleküle des Lösungsmittels ein Dipolmoment aufweisen und deshalb mit geladenen (Ionen) oder ihrerseits polaren Molekülen der zu lösenden Substanz in Wechselwirkung treten, jedoch ohne dass es zu einer Reaktion kommt. Die Polarität von Lösungsmitteln ist skalierbar. Unterschiedliche Polaritäten und damit unterschiedliche Löslichkeiten werden in Chromatografie-Verfahren ausgiebig genutzt.
Viele Substanzen, wie zum Beispiel Ethanol, sind sowohl mit Wasser als auch mit unpolaren Lösungsmitteln gut mischbar. Aceton ist mit fast jeder Flüssigkeit mischbar.
Quantitative Löslichkeit
Löslichkeit und Löslichkeitsprodukt
Die Löslichkeit eines Stoffes in einem Lösungsmittel ist nicht in allen Fällen begrenzt. So ist Schwefelsäure mit Wasser in einem beliebigen Verhältnis mischbar.
Bei der Mischung von Phenol mit Wasser gibt es dagegen zwei Bereiche: eine Lösung von Phenol in Wasser und eine Lösung von Wasser in Phenol. Dazwischen bleibt ein Bereich „verbotener“ Mischungsverhältnisse ausgespart, der zur Ausbildung einer Schichtung von zwei flüssigen Phasen führt.
Die quantitative Löslichkeit oder Löslichkeitsgrenze gibt bei begrenzt löslichen Systemen die maximale Konzentration des einen Stoffes in dem anderen an, in dem das Gemisch unter Gleichgewichtsbedingungen noch einphasig ist. Die Löslichkeitsgrenze ist temperaturabhängig. Wird die Löslichkeitsgrenze überschritten, so scheidet sich eine zweite Phase aus. Fehlt die nötige Aktivierungsenergie oder Diffusion für das Ausscheiden der zweiten Phase, so bleibt das Gemisch auch oberhalb der Löslichkeitsgrenze einphasig in einem metastabilen, übersättigten Zustand. Bei Salzen folgt die Löslichkeit aus dem Löslichkeitsprodukt.
Liegt keines der beteiligten Ionen zusätzlich aus einer anderen Quelle vor, kann die Löslichkeit des betreffenden Salzes berechnet werden. Die Löslichkeit des Salzes AmBn ist:
In gemischten Lösungen, wie z. B. in natürlichen Wassern, kommt es regelmäßig vor, dass die Konzentrationen von Anionen und Kationen nicht stöchiometrisch paarweise übereinstimmen, wie es der Lösung einzelner Salze entspräche. Ein wichtiges Beispiel hierfür ist der gelöste Kalk, der durch gelöstes Kohlenstoffdioxid als Calciumhydrogencarbonat in Lösung geht und den wesentlichen Beitrag zur Wasserhärte bildet. Über das Dissoziationsgleichgewicht der Kohlensäure verschieben sich mit den ständig wechselnden Kohlenstoffdioxid-Gehalten des Wassers (z. B. durch Atmung und Photosynthese der Wasserorganismen) auch die Konzentrationen der Carbonat- und Hydrogencarbonat-Anionen, während die Konzentration der Calcium-Kationen davon zunächst unberührt bleibt. In diesem Fall entscheidet das Produkt aus den durchaus nicht äquivalenten Konzentrationen an Calcium- und Carbonat-Ionen darüber, ob und in welchem Umfang es wegen einer Überschreitung des Löslichkeitsproduktes zu einer Ausfällung von Calciumcarbonat (z. B. als Kesselstein oder Seekreide) kommt.
Die quantitative Löslichkeit wird, wie allgemein die Konzentration von Lösungen, in verschiedenen Einheiten angegeben:
- g/l Lösung (Massekonzentration)
- g/100 g Lösung (Masseprozent)
- ml/100 ml Lösung (Volumenprozent, Vol.-%)
- g/kg Lösung (Massegehalt)
- mol/l Lösung (Molarität)
- val/l Lösung (Normalität)
- mol/kg Lösemittel (Molalität)
Beispiel für die Löslichkeitsberechnung eines Einzelsalzes
Berechnung der Löslichkeit L für Aluminiumsulfat in Wasser, bei bekanntem KL
Das heißt: aus jedem Mol Aluminiumsulfat entstehen in der Lösung 2 Mol Aluminium- und 3 Mol Sulfationen. Weiterhin gilt folgender Zusammenhang zwischen Reaktionskonstante KL und der Löslichkeit L:
Die Faktoren vor L erklären sich durch den Stöchiometrischen Faktor.
Dies setzt man nun in die Gleichung für KL ein, daraus folgt dann:damit
Die Zahlenwerte für die Löslichkeitsprodukte erhält man aus den freien Standard-Enthalpien.
Lösung von Gasen in Flüssigkeiten
An der Grenzfläche zwischen Gasen und Flüssigkeiten kommt es durch Diffusion zum Austausch von Gasmolekülen zwischen der Lösung und dem Gasraum. Dabei ist der Eintritt von Molekülen in die Lösung proportional dem Partialdruck des Gases, und der Austritt ist proportional der Konzentration des Gases in der Lösung (siehe Henry-Gesetz). Bei der sogenannten „Sättigungskonzentration“ herrscht ein dynamisches Gleichgewicht zwischen beiden Diffusionsrichtungen. Die Sättigungskonzentration ist proportional zum Partialdruck im Gasraum. Die verbindende Proportionalitätskonstante wird hier als Löslichkeit, präziser als Löslichkeitskoeffizient, bezeichnet:
Gaslöslichkeit(Gas i) = Sättigungskonzentration(i) / Partialdruck(i)
Der Index i bezieht sich dabei auf ein einzelnes Gas in möglichen gemischten Lösungen, wie etwa bei der Lösung des Gasgemisches „Luft“ in Wasser.
In der Regel nimmt diese Löslichkeit von Gasen in Flüssigkeiten mit steigender Temperatur ab. Ebenso wirken sich im Wasser gelöste Feststoffe mindernd auf die Gaslöslichkeit aus. Deshalb ist beispielsweise in Meerwasser weniger Sauerstoff löslich als in Süßwasser.
Eine Abweichung von der Proportionalität zwischen Gasdruck und Gleichgewichtskonzentration macht sich erst bei sehr hohen Drücken (im Vergleich zum Atmosphärendruck) bemerkbar.
Lösung von Metallen in Metallen
Im normalen Sprachgebrauch stellt man sich unter Lösungen meist flüssige Medien vor, aber es gibt (bei Raumtemperatur) auch feste Lösungen z. B. die Legierungen, also Lösungen von Metallen in Metallen. Sie sind verbreitet wegen ihrer besonderen Werkstoff-Eigenschaften im Einsatz. Bronze ist die älteste von Menschen bewusst hergestellte Legierung. Messing und die verschiedenen Stähle sind bekannte Beispiele. Auch Schmuckgold ist meist eine Legierung von Gold mit Silber (Weißgold) oder Kupfer (Rotgold), deren Goldanteil in Karat angegeben wird.
Siehe auch
Einzelnachweise
- ↑ Jander, Blasius: Einführung in das anorganisch-Chemische Praktikum. S.Hirzel, Leipzig 1995 (14. Aufl.), ISBN 3-7776-0672-3
Weblinks
Wikimedia Foundation.

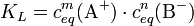
![L = \frac{c_{eq}\mathrm(A^+)}{m} = \frac{c_{eq}\mathrm(B^-)}{n} = \sqrt[n+m]{\frac{K_L}{n^n \cdot m^m}}](/pictures/dewiki/48/0dfd4659a87645adabca9850e7417249.png)
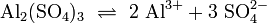
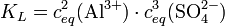
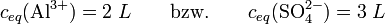
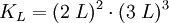
![L = \sqrt[5]{\frac{K_L}{2^2\cdot3^3}}](/pictures/dewiki/55/703125d17ef4d4542d06d027c9f784f8.png)