- L-Tryptophan
-
Strukturformel 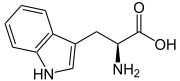
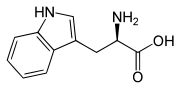
L-Tryptophan (oben) bzw. D-Tryptophan (unten)Allgemeines Freiname Tryptophan Andere Namen - Abk.: Trp (Dreibuchstabencode)
W (Einbuchstabencode) - L-Tryptophan
- (RS)-Tryptophan
- IUPAC: 2-Amino-3-(1H-indol-3-yl)propansäure (ohne Stereochemie)
Summenformel C11H12N2O2 CAS-Nummer - 73-22-3 (L-Tryptophan)
- 153-94-6 (D-Tryptophan)
PubChem 6305 ATC-Code N06AX02
DrugBank NUTR00058 Kurzbeschreibung weiß bis grünlichgelbes Pulver Arzneistoffangaben Wirkstoffklasse - Antidepressiva
- Aminosäuren, inkl. Kombinationen mit Polypeptiden
- Lösungen zur parenteralen Ernährung
Wirkmechanismus Hormonvorstufe, Nahrungsmittel
Fertigpräparate - L-Tryptophan-ratiopharm® (D)
- Ardeydorm® (D)
Verschreibungspflichtig: Teilweise Eigenschaften Molare Masse 204,23 g·mol−1 Aggregatzustand Feststoff
Schmelzpunkt 290 °C
Siedepunkt 290–291 °C (Zers.) [1]
Dampfdruck 2,12·10−9 mm Hg bei 25 °C [1]
pKs-Wert pKCOOH: 2,43
- pKNH2: 9,44[2]
Löslichkeit - schlecht in Wasser (10 g·l−1 bei 20 °C,
13,4 g/l bei 25 °C) [1] - wenig löslich in Ethanol
- besser in mineralischen Säuren, Laugen, Fett
Sicherheitshinweise Gefahrstoffkennzeichnung [3] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tryptophan (Abk. Trp oder W) ist in der L-Form eine proteinogene α-Aminosäure [Synonym für L-Tryptophan: (S)-Tryptophan] mit einem aromatischen Indol-Ringsystem. Gemeinsam mit Phenylalanin, Tyrosin und Histidin zählt Tryptophan daher zu den aromatischen Aminosäuren. Es gehört zu den essentiellen Aminosäuren, kann also vom menschlichen Körper nicht gebildet und muss mit der Nahrung zugeführt werden. D-Tryptophan (molekulares Spiegelbild von L-Tryptophan) sowie das Racemat DL-Tryptophan besitzen nur eine geringe Bedeutung.
Inhaltsverzeichnis
Vorkommen
L-Tryptophan wird bei der Spaltung von Proteinen mit Trypsin erhalten (gr. φαίυω: leuchten, erscheinen). L-Tryptophan ist in vielen Lebensmitteln enthalten. Vor allem in Milch und Milchprodukten wie z. B. Käse kommt es in hoher Konzentration in Form von Lactalbumin vor. Es findet sich aber auch reichlich in Geflügel, Rindfleisch, Eiern, Erbsen, Nüssen und Kartoffeln.
L-Tryptophan ist auch in Kakaobohnen (Schokolade) enthalten. Als Vorstufe des auch als „Glückshormon“ bezeichneten menschlichen Neurotransmitters Serotonin ist L-Tryptophan für die leicht stimmungsaufhellende Wirkung von Schokolade mitverantwortlich. Der hohe L-Tryptophangehalt der Milch scheint für ihre schlaffördernde Wirkung verantwortlich zu sein.
Eigenschaften
- Chemische Eigenschaften
Die Aminosäuren-Seitenkette von Tryptophan ist lipophil und aromatisch. Daher ist es schlecht wasserlöslich. Sein isoelektrischer Punkt liegt bei 5,89, der pKCOOH ist 2,4, der pKNH2 9,3 (beide bei 25 °C).
Das van-der-Waals-Volumen von Tryptophan ist 163 und der Hydrophobizitätsgrad −0,9. Freies Tryptophan als auch proteingebundene Tryptophan-Einheiten fluoreszieren unter UV-Licht, so wie es auch bei den übrigen aromatischen Aminosäuren (Tyrosin, Phenylalanin und Histidin) beobachtbar ist.
Gewinnung und Darstellung
Biosynthese
Pflanzen und Mikroorganismen können L-Tryptophan herstellen, unter anderem aus der Shikimisäure bzw. Anthranilat.[4] Letzteres kondensiert mit Phophoribosylpyrophosphat (PRPP) unter Abspaltung von Diphosphat. Nach Umlagerung des Ribosanteils und einer folgenden Decarboxylierung nebst Dehydratisierung entsteht schließlich Indol-3-glycerinphosphat, was zu Indol gespalten wird. Im letzten Schritt katalysiert die Tryptophan-Synthetase[5] die Bildung von Tryptophan ausgehend von Indol und Serin.
Industrielle Synthese
Die industrielle Produktion von L-Tryptophan geschieht ebenfalls biosynthetisch aus L-Serin und Indol und nutzt dazu eine Wildtypmutante von E. coli. Die Umsetzung wird dabei durch das Enzym Tryptophansynthase katalysiert.[5]
Verwendung
Arzneimittel/Nahrungsergänzung/Ernährung
Als Bestandteil von Nährlösungen [Aminoplasmal® (D), Aminosteril®-N-Hepa (D)] zur parenteralen Ernährung findet L-Tryptophan, neben anderen Aminosäuren, breite Anwendung.
Wirkung
Die Wirkung von L-Tryptophan wird oft als stimmungsaufhellend, beruhigend und gewichtsreduzierend beschrieben. Die stimmungsaufhellende Wirkung von L-Tryptophan beruht dabei vermutlich auf der Tatsache, dass es im menschlichen Körper zu Serotonin umgewandelt wird. Es wird angenommen, dass durch einen erhöhten Serotoninspiegel die Stimmung aufgehellt und Depressionen gelindert werden können. Als Nebenwirkungen können dabei vor allem Tagesmüdigkeit, Schwindel und Kopfschmerzen auftreten. Eine weitere seltene Nebenwirkung ist die eosinophile Fasziitis, die gehäuft unter Einnahme von L-Tryptophan beobachtet wird (siehe auch EMS durch Serotoninvorstufen).[6]
Pharmakologie
L-Tryptophan gilt als „natürliches Antidepressivum“, ihm wird eine gute Wirksamkeit bei depressiven Erkrankungen bei gleichzeitig geringen Nebenwirkungen nachgesagt. Außerdem ist L-Tryptophan billiger als rezeptpflichtige Antidepressiva. (Natürlich nur nominell, da die meisten rezeptpflichtigen Antidepressiva von der Krankenkasse gezahlt werden und nach Verschreibung nur noch die relativ geringe Zuzahlung fällig wird. Rezeptfreie Mittel müssen in der Regel selbst gezahlt werden.)
Als schlichte Nahrungsergänzung ist L-Tryptophan nur bei gesichertem Mangel sinnvoll, der in Industrieländern praktisch unbekannt ist. Bei einer Fruktosemalabsorption ist jedoch ein signifikant erniedrigter Serumtryptophanspiegel beobachtet worden.[7] Der Spiegel dieser essentiellen L-Aminosäure, dem Vorläufer des Serotonins, in der Nährflüssigkeit des Gehirns, ist nicht beliebig durch Verzehr entsprechend eiweißhaltiger Nahrung zu bewerkstelligen, denn L-Tryptophan konkurriert mit fünf anderen Aminosäuren an der Blut-Hirn-Schranke um das Eindringen in die Nährflüssigkeit des Gehirns; nämlich mit den verzweigtkettigen (das sind L-Valin, L-Leucin und L-Isoleucin) und zwei aromatischen (L-Phenylalanin und L-Tyrosin) Aminosäuren.[8] Dennoch lässt sich durch schlichte Nahrungsaufnahme der L-Tryptophanspiegel heben, indem man längere Zeit nach der letzten Mahlzeit eine durchaus bescheidene Menge eiweißreicher Kost verzehrt. L-Tryptophan kann als eine der wenigen nicht verzweigtkettigen Aminosäuren angesehen werden, die in einer Zeit geringen Nahrungsangebots nicht von den „gierigen“ Muskeln des Körpers aufgenommen werden. Die Aminosäure übersteigt dann bei geringer Konkurrenz anderer Aminosäuren leicht die Blut-Hirn-Schranke. Damit ist eine Voraussetzung für die ausreichende Bildung des wichtigen Hormons und Botenstoffes Serotonin auch in Hungerperioden gegeben.
Im Prinzip ist es möglich, statt L-Tryptophan auch L-5-Hydroxytryptophan einzunehmen. 5-HTP wird sogar wesentlich effizienter zu Serotonin verstoffwechselt; man kann also die gleiche serotonerge Wirkung von L-Tryptophan auch mit einer geringeren Menge 5-HTP erzielen. Die Einnahme ist jedoch mit der Gefahr ernster Gesundheitsschäden bei längerfristiger und/oder hochdosierter Einnahme und im allgemeinen mit mehr Nebenwirkungen verbunden. (Vgl. dazu 5-HTP: Präparat)
Dosierung
Zu einer Überdosierung von L-Tryptophan kommt es nur schwerlich, da L-Tryptophan selbst der Hauptaktivator seines abbauenden Enzyms Tryptophan-Pyrrolase (genauer: Tryptophan-2,3-Dioxygenase) ist.[9] Ein weiterer Aktivator ist Cortisol. Dies liefert auch eine Erklärung dafür, dass Stress (und der dadurch erhöhte Cortisolspiegel) zu einem verminderten Umsatz von L-Tryptophan zu 5-HTP führt. Vitamin-B3 hingegen hemmt die Aktivität des Enzyms und fördert so den Umsatz von L-Tryptophan zu 5-HTP. Tryptophan-Pyrrolase baut L-Tryptophan unter Sauerstoffverbrauch zu N-Formyl-L-Kynurenin ab, welches in weitere Stoffe umgewandelt werden kann (u. a. Vitamin-B3). Dies ist auch der Hauptstoffwechselweg von L-Tryptophan (nur etwa 3 % wird zu 5-HTP bzw. Serotonin umgewandelt[10]). Dabei fungiert Häm (Eisen!) als Cofaktor. Einer Erhöhung der Zufuhr von L-Tryptophan steht ab einer gewissen Grenze eine überproportionale Aktivierung der Tryptophan-Pyrrolase gegenüber, so dass im Ergebnis mehr L-Tryptophan abgebaut wird, als zusätzlich zugeführt worden ist.[8]
Rechtliche Situation
L-Tryptophan ist in Deutschland rezeptfrei in Apotheken erhältlich. Es wird allerdings nicht als Stimmungsaufheller, sondern als mildes Schlaf- und Beruhigungsmittel verkauft (Dosis: 250 und 500 mg L-Tryptophan / Tablette oder als Pulver in variablen Packungsgrößen.). 5-Hydroxytryptophan ist hierzulande ein rezeptpflichtiges Medikament und nicht frei erhältlich.
In Österreich sowie in der Schweiz ist L-Tryptophan rezeptpflichtig.
L-Tryptophan war bis Januar 1996 in den USA verboten. Das Verbot in den USA hatte mit dem Fall des verunreinigten L-Tryptophans zu tun, welches das japanische Unternehmen Showa Denko in den 1980er Jahren auf gentechnischem Wege hergestellt hat und wodurch vermutlich die mitunter tödlich verlaufende Blutkrankeit EMS-Syndrom (Eosinophile-Myalgie-Syndrom) ausgelöst wurde.
Futtermittel
Viele Getreidesorten weisen einen zu geringen Gehalt einer essentiellen Aminosäure auf. Durch diesen Mangel an nur einer Aminosäure sinkt die Verwertbarkeit aller aufgenommenen Aminosäuren auf den durch die in zu geringer Menge enthaltene essentielle Aminosäure („limitierende Aminosäure“)[11] bestimmten Wert. Man steigert den Nährwert des Getreides dann durch den gezielten Zusatz geringer Mengen jener essentieller Aminosäuren, die darin defizitär sind. Der Zusatz von L-Tryptophan zu Mischfuttern ist in der Futtermittel-Industrie verbreitet.[12]
Biologische Bedeutung
Das Codon UGG codiert die Aminosäure Tryptophan.
- L-Tryptophan ist am Aufbau von diversen Proteinen im menschlichen Körper beteiligt, z. B. in den Muskeln, im Apolipoprotein B100 (Teil des Cholesterin-Transportmoleküls LDL) oder in Enzymen.
- Es dient als Vorläufer für verschiedene Botenstoffe (Neurotransmitter, Hormone) wie Serotonin und Melatonin.
- L-Tryptophan ist Provitamin für Vitamin B3.
Serotoninsynthese (Mensch)
L-Tryptophan wird durch das Enzym Tryptophan-Hydroxylase (TPH)[13] in 5-Hydroxytryptophan (5-HTP) überführt. Die Tryptophanhydroxylase kann durch eine Reihe an Faktoren gehemmt werden, so z. B. durch Vitamin-B6- / Vitamin-B3-Mangel, Insulinresistenz, Magnesiummangel, aber auch durch Stress. Da der Übergang vom L-Tryptophan zum 5-HTP bei der körpereigenen Serotoninsynthese der geschwindigkeitsbestimmende Schritt ist, kommt der Tryptophan-Hydroxylase eine wichtige Regelfunktion dieses Syntheseweges zu.
5-HTP (auch bekannt unter dem Namen Oxitriptan) wird durch das Enzym Hydroxytryptophan-Decarboxylase (genauer: Aromatische-L-Aminosäure-Decarboxylase, AADC) [14] in Serotonin überführt. Das Vitamin-B6-Derivat Pyridoxalphosphat wirkt dabei als Cofaktor und verstärkt (oder vermindert) in Abhängigkeit seines Vorhandenseins die Aktivität der Hydroxytryptophan-Decarboxylase.[15]
Abbau von Tryptophan
Der Abbau von L-Tryptophan erfordert die Spaltung beider aromatischer Ringe, was durch Oxygenasen katalysiert wird. Dabei wird durch die Tryptophan-2,3-Dioxygenase zunächst der Pyrrolring aufgebrochen, wodurch über die Abspaltung von Ameisensäure (mithilfe der Arylformamidase) Kynurenin entsteht. Dieses wird durch die Kynurenin-3-Monooxygenase[16], zu 3-Hydroxykynurenin umgesetzt. Cofaktor ist dabei FAD, Cosubstrate molekularer Sauerstoff und NADPH. Nach Abspaltung von Alanin (mittels Kynureninase) katalysiert eine weitere Dioxygenase, die 3-Hydroxyanthranilat-3,4-Dioxygenase, die Spaltung des verbliebenen Aromatenrings, so dass nach mehreren Reaktionsschritten schließlich Acetacetat vorliegt. Der Aldehyd, der nach Anwendung der zweiten Dioxygenase entsteht, wird teilweise beim Aufbau von NAD+ verwendet.
Mehrere der beim Abbau beteiligten Enzyme scheinen bei Ratten im Alter an Aktivität zu verlieren.[17]
Siehe auch
Literatur
- Berg/Tymoczko/Stryer: Biochemie, 5. Auflage, Spektrum Akademischer Verlag GmbH Heidelberg 2003, ISBN 3827413036.
Weblinks
Einzelnachweise
- ↑ a b c d Tryptophan bei ChemIDplus
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart, 1991, ISBN 3-7776-0485-2, S. 823.
- ↑ Datenblatt bei Merck.
- ↑ Radwanski ER, Last RL (1995), Tryptophan biosynthesis and metabolism: biochemical and molecular genetics. Plant Cell 7 (7): 921–34; PMID 7640526; PDF (freier Volltextzugriff)
- ↑ a b EC 4.2.1.20
- ↑ Wojas-Pelc A, Wielowieyska-Szybińska D, Lipko-Godlewska S: Eosinophilic fasciitis – current knowledge, in: Przegl Lek. 2003;60(2):116–119; PMID 12939859.
- ↑ Ledochowski M, Widner B, Fuchs D. Fructose malabsorption and the decrease of serum tryptophan concentration. Huether G Kochen W Simat TJ Steinhart H eds. Tryptophan, serotonin, and melatonin: basic aspects and applications 1999:73–78 Kluwer Academic/Plenum Publishers New York.
- ↑ a b L-Tryptophan – nature’s answer to Prozac by James South MA
- ↑ EC 1.13.11.11
- ↑ Arzneimittel-Telegram 1/90, S. 8, „Parallelen zwischen L-Tryptophan und Hydroxy-Tryptophan (Levothym)?“
- ↑ Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Herstellung und Verwendung von Aminosäuren, Angewandte Chemie 90 (1978) 187-194; Angewandte Chemie International Edition in English 17, 176-183.
- ↑ Manfred Kircher und Wolfgang Leuchtenberger: Aminosäuren - ein Beitrag zur Welternährung, Biologie in unserer Zeit 28 (1998) 281-293.
- ↑ EC 1.14.16.4
- ↑ EC 4.1.1.28
- ↑ 5-HTP: Doc Harris Presents Green Banana Award by Steven B. Harris, M.D.
- ↑ EC 1.14.13.9
- ↑ Comai S, Costa CV, Ragazzi E, Bertazzo A, Allegri G: The effect of age on the enzyme activities of tryptophan metabolism along the kynurenine pathway in rats. In: Clin. Chim. Acta. 360, Nr. 1-2, October 2005, S. 67–80. doi:10.1016/j.cccn.2005.04.013. PMID 15970278
Bitte beachte den Hinweis zu Gesundheitsthemen! Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
- Abk.: Trp (Dreibuchstabencode)
Wikimedia Foundation.




