- Kaliumdichromat
-
Strukturformel 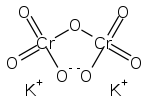
Allgemeines Name Kaliumdichromat Andere Namen - Kaliumbichromat
- Doppeltchromsaures Kalium
- Pyrochromsaures Kalium
- Chromkali
Summenformel K2Cr2O7 CAS-Nummer 7778-50-9 PubChem 516855 Kurzbeschreibung orangerote, nicht hygroskopische, trikline Tafeln[1]
Eigenschaften Molare Masse 294,19 g·mol−1 Aggregatzustand fest
Dichte - 2,68 g·cm−3 (α-Modifikation)[2]
- 2,10 g·cm−3 (β-Modifikation)[2]
Schmelzpunkt Siedepunkt thermische Zersetzung: ~ 500 °C[2]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 




Gefahr
H- und P-Sätze H: 272-350-340-360FD-330-301-372-312-314-334-317-410 EUH: keine EUH-Sätze P: 201-280-301+330+331-305+351+338-304+341-308+313 [2] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 


Sehr giftig Umwelt-
gefährlichBrand-
fördernd(T+) (N) (O) R- und S-Sätze R: 45-46-60-61-8-26-25-21-34-42/43-48/23-50/53 S: 53-45-60-61 MAK aufgehoben, da karzinogen[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumdichromat, K2Cr2O7, ist das Kaliumsalz der in freier Form instabilen Dichromsäure. Andere Bezeichnungen sind: Kaliumbichromat, Doppeltchromsaures Kalium, Pyrochromsaures Kalium, Chromkali, englisch: Potassium dichromate.
Inhaltsverzeichnis
Historisches
Im Jahre 1856 wurde von W. H. Perkin bei der Oxidation von unreinem Anilin mit Kaliumdichromat der erste künstlich hergestellte Farbstoff, das Mauvein (auch Perkinviolett), entdeckt.
Gewinnung und Darstellung
Die technische Herstellung erfolgt durch Zusammenschmelzen von Chromeisenstein, Kaliumcarbonat (Pottasche) und Calciumcarbonat und Oxidation durch eingeblasene Luft. Es entsteht dabei zunächst das gelbe Kaliumchromat K2CrO4, welches ausgelaugt wird und nach Säurezugabe und Umkristallisation Kaliumdichromat liefert.
Im Labormaßstab kann Kaliumdichromat durch Zusammenschmelzen von Kaliumnitrat und Chrom(III)-oxid gewonnen werden.

- Chromoxid reagiert mit Kaliumnitrat zu Kaliumdichromat und Stickstoffmonoxid
Eigenschaften
Kaliumdichromat bildet leuchtend orangerote Kristalle ohne Kristallwasser, die einen Schmelzpunkt von 397 °C haben und sich ab 500 °C unter Sauerstoffabgabe zu Kaliumchromat K2CrO4 und Chrom(III)-oxid Cr2O3 zersetzen.
Kaliumdichromat ist ein starkes Oxidationsmittel, besonders in saurer Lösung. In alkalischem Milieu liegt hauptsächlich das gelbe Chromat CrO42− vor, welches weit weniger stark oxidierend wirkt. Kaliumdichromat ist gut wasserlöslich. Das Dichromat-Anion Cr2O72− steht in wässriger Lösung im Gleichgewicht mit HCrO4−, CrO42−. Daher bilden sich mit Barium-, Blei- und Silberionen (Ba2+, Pb2+, Ag+) gelbe schwerlösliche Chromate und nicht Dichromate. Viele Säureanionen reagieren zu weiteren Anionenkomplexen, beispielsweise entsteht in Salzsäure CrO3Cl− welches als Kaliumsalz auskristallisiert werden kann. Ähnlich reagieren auch Bromid und Iodid, denn obwohl (thermodynamisch) eigentlich die Oxidation zu den elementaren Halogenen stattfinden müsste, wird die Oxidation durch die geringe Reaktionsgeschwindigkeit verhindert (kinetische Hemmung). Das Chrom im Kaliumdichromat besitzt die Oxidationszahl +VI.
Verwendung
Im Labor wird Kaliumdichromat wegen der guten Lagerfähigkeit und Wägbarkeit als verbreitetes Oxidationsmittel, Reagenz (Nachweis von Wasserstoffperoxid durch Blaufärbung) und Urtitersubstanz eingesetzt. In der Technik wird es in der Gerberei, der Galvanoplastik und zur Herstellung von Chromschwefelsäure benutzt. In der Fotografie und den Edeldruckverfahren wird Kaliumdichromat als lichtempfindliche, Kolloide gerbende Substanz verwendet, besonders im Lichtdruck und Gummidruck. In der Neurohistologie wurde von Camillo Golgi eine Methode zum Anfärben einzelner Nerven und Neurone entwickelt. Als „Schwarze Reaktion“ bekannt, werden so Nervenzellen bis in feinste Strukturen mit Hilfe von Kaliumdichromat und Silbernitrat gefärbt.
Kaliumdichromat war früher in Chemiebaukästen enthalten. Der Stoff sollte im Originalbehälter zur Problemmüllsammlung oder zu einem Entsorgungsunternehmen gebracht werden.
Gefahrenhinweise
Obwohl der Stoff bis vor wenigen Jahren noch als Xi (reizend) eingestuft war und sich in vielen Kristallzuchtkästen und Chemiekästen für Kinder befand, ist Kaliumdichromat heute als sehr giftig, brandfördernd, umweltgefährlich, erbgutverändernd, fortpflanzungsgefährdend und krebserzeugend eingestuft. Es reizt die Haut, Atmungsorgane und die Augen. Bei wiederholtem Hautkontakt tritt Sensibilisierung ein, es können sogar Allergien entstehen.
Mit organischen, brennbaren Verbindungen, Reduktionsmitteln, konzentrierter Schwefelsäure, Metallen in Pulverform (besonders: Magnesium, Eisen) sind heftige Reaktionen bis zur Selbstentzündung oder Explosion möglich. Kaliumdichromat ist zwar nicht brennbar, aber brandfördernd. Die Entsorgung von Kaliumdichromat kann mit Eisensulfat erfolgen, wobei es zu Cr3+ reduziert wird, welches ausgefällt als unlösliches Chromhydroxid wesentlich ungefährlicher ist. Gewerbliche Chromatvergiftungen sind melde- und entschädigungspflichtige Berufskrankheiten.
Einzelnachweise
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c d e f g h Eintrag zu Kaliumdichromat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. August 2007 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 7778-50-9 im European chemical Substances Information System ESIS (ergänzender Eintrag)
Kategorien:- Krebserzeugender Stoff
- Erbgutverändernder Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Giftiger Stoff
- Gesundheitsschädlicher Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Brandfördernder Stoff
- Chromat
- Kaliumverbindung
Wikimedia Foundation.

