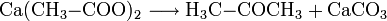- (CH3COO)2Ca
-
Strukturformel 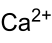


![\mathrm{ \ \!\ \Biggr]_2}](/pictures/dewiki/48/07a3843eb4b51c9bed598e32e34f28db.png)
Allgemeines Name Calciumacetat Andere Namen - Calciumethanoat (nach IUPAC)
- Kalziumacetat
- Calciumdiacetat
Summenformel Ca(C2H3O2)2 CAS-Nummer 62-54-4 (wasserfrei)
114460-21-8 (Hydrat)ATC-Code A12AA12
Kurzbeschreibung farbloser Feststoff [1] Eigenschaften Molare Masse 158,17 g·mol−1 Aggregatzustand fest
Dichte 2,341 g·cm−3 [2]
Schmelzpunkt Zersetzung: ab 160 °C [1]
Löslichkeit - sehr leicht löslich in Wasser
- nicht löslich in Ethanol und Öl
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 4280 mg·kg−1 (Ratte, oral) [3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Calciumacetat (E 263) ist eine chemische Verbindung mit der chemischen Formel Ca(H3CCOO)2. Es ist ein Calcium-Salz der Essigsäure. Es ist ein weißer Feststoff, mit leichtem Geruch nach Essigsäure und stark herbem Geschmack.
In der Lieferform enthält Calciumacetat wechselnde Mengen Kristallwasser. Bei normalen Bedingungen (Raumtemperatur, 65 % Luftfeuchtigkeit) ist die Verbindung mit etwa 2 Mol Kristallwasser beständig. Bei 60 °C löst sich die Verbindung im eigenen Kristallwasser, was einem Schmelzen gleichkommt. Bei höheren Temperaturen zerfällt die Verbindung in Aceton und Calciumcarbonat nach folgender Reaktionsgleichung:
Verwendung
Es wird unter der Nummer E 263 als säureregulierender und konservierender Lebensmittelzusatzstoff verwendet.
Calciumacetat wird oft als Extraktionsmittel für Bodenproben gebraucht. Zudem wird es in Kombination mit Brennspiritus als Brennpaste verwendet.
Darüber hinaus wird es als Medikament zur Behandlung erhöhter Phosphatspiegel bei chronischer Niereninsuffizienz in der Nephrologie eingesetzt.
Auch die Vielerorts erhältlichen Taschenwärmer enthalten eine Calcium- oder Natriumacetatlösung. Durch Verformung des Metallplätchens entsteht ein Kristallisationskeim. Nach wenigen Sekunden ist das gesamte Acetat kristallisiert und die Kristallisationswärme wärmt für ca. 15 Minuten.
Quellen
- ↑ a b c Eintrag zu Calciumacetat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 2. Dez. 2007 (JavaScript erforderlich)
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, Seite 629.
- ↑ Sicherheitsdatenblatt (Carl Roth)
Wikimedia Foundation.