- D-Glucose
-
Strukturformel 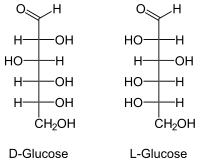
Allgemeines Name Glucose Andere Namen Summenformel C6H12O6 CAS-Nummer 50-99-7 ATC-Code Kurzbeschreibung farb- und geruchloser Feststoff [1]
rel. Süßkraft (nur D-Glucose) = 0,42 [2]Eigenschaften Molare Masse 180,16 g·mol−1 Aggregatzustand fest
Dichte 1,5620 g·cm−3 [3]
Schmelzpunkt 146 °C [1]
Löslichkeit gut in Wasser (470 g·l−1 bei 20 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 25,8 g·kg−1 (Ratte, oral) [4]
WGK 1 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Glucose (kurz Glc, auch Dextrose genannt; eingedeutschte Schreibung Glukose), ist ein Einfachzucker (Monosaccharid) und gehört damit zu den Kohlenhydraten. Es besteht aus zwei Enantiomeren, die als D- und L-Glucose bezeichnet werden. In der Natur kommt ausschließlich D-Glucose vor. Diese wird umgangssprachlich als Traubenzucker bezeichnet. Bei der nur synthetisch zugänglichen L-Glucose handelt es sich nicht um Traubenzucker.
Inhaltsverzeichnis
Etymologie
Der Traubenzucker wurde 1792 von Johann Tobias Lowitz in Weintrauben entdeckt und als von Rohrzucker verschieden erkannt. D-Glucose ist der von Jean Baptiste Dumas 1838 geprägte Fachbegriff dafür. Sein Kollege Friedrich August Kekulé hielt den Namen Dextrose (von Lateinisch dexter = rechts) für passender, da gewöhnlicher Traubenzucker die physikalische Eigenschaft besitzt, die Ebene des linear polarisierten Lichtes nach rechts zu verdrehen. Im Gegensatz dazu dreht Levulose polarisiertes Licht nach links.
Biologie und Biochemie
Glucose ist indirekt ein Produkt der Photosynthese: Sie entsteht im Zytosol und in den Vakuolen durch die über die Invertase vermittelte Spaltung von Saccharose; in den Chloroplasten wird sie beim Abbau der Stärke freigesetzt, der durch Amylasen katalysiert wird. Glucose stellt für Pflanzen und Tiere eine wichtige Energiequelle für die ATP-Synthese dar und hat wichtige Signalfunktionen: Zum Beispiel übt Glucose in den Pflanzen eine Feedback-Hemmung auf die Photosynthese aus und ist an der Regulation des Keimungszeitpunktes sowie an der Induktion der Blütensprossbildung beteiligt. In Pflanzen und Tieren liefert dieser Zucker das Kohlenstoffgerüst für die Synthese von Aminosäuren und Lipiden. Tiere nehmen Glucose entweder direkt aus der Nahrung auf oder gewinnen sie aus dem Abbau von Stärke oder körpereigenem Glycogen. Die roten Blutkörperchen und das Nierenmark sind sogar völlig auf Traubenzucker zur Energiegewinnung angewiesen, das Gehirn zum Teil. Im Hungerstoffwechsel kann das Gehirn bis zu 80 % der Energie aus Ketokörpern beziehen. Der Glucosegehalt des Blutes beträgt etwa 0,1 % und wird durch die Hormone Insulin und Glucagon geregelt. Auch andere Hormone haben Einfluss auf den Glucosegehalt des Blutes, allerdings ist Insulin das einzige Hormon, das einen senkenden Einfluss ausübt.
Glucose dient den meisten Wirbeltieren als Ausgangsstoff zur Produktion von Vitamin C. Nur wenige Wirbeltiere, darunter Primaten (wie der Mensch), Meerschweinchen, einige Vögel und Schlangen, sind nicht zur Biosynthese von Ascorbinsäure aus Glucuronsäure, einem Oxidationsprodukt von Glucose, befähigt, da ihnen die L-Gluconolacton-Oxidase fehlt.
Traubenzucker kann im Körper über die Glycolyse, die Oxidative Decarboxylierung, den Citratzyklus und die Atmungskette vollständig zu Wasser und Kohlenstoffdioxid abgebaut werden. Ist dafür nicht genügend Sauerstoff verfügbar, erfolgt der Glucoseabbau anaerob bis zum Lactat durch die Milchsäuregärung und setzt weniger Energie frei. Bei hohem Angebot an Glucose kann der Metabolit Acetyl-CoA aber auch zur Fettsäuresynthese genutzt werden. Ebenfalls wird durch Glucose der Glycogen-Speicher des Körpers wieder aufgefüllt, der vor allem in Leber und Skelettmuskulatur zu finden ist. Diese Vorgänge werden hormonell reguliert. Durch die Gluconeogenese kann der Organismus Glucose aus anderen Stoffwechselprodukten, u. a. aus Lactat oder bestimmten Aminosäuren unter Energieverbrauch aufbauen. Die Neubildung von bis zu 250 g Glucose am Tag findet hauptsächlich in der Leber statt. Auch die Tubuluszellen der Nieren können Glucose bilden.
Vorkommen und technische Gewinnung
Traubenzucker ist als Baustein in Zweifachzuckern wie Milchzucker oder Rohrzucker, in Mehrfachzuckern wie Raffinose und in Vielfachzuckern wie Stärke, Glycogen oder Cellulose enthalten. Er wird durch die vollständige enzymatische Spaltung von Stärke (z. B. aus Mais oder Kartoffeln) hergestellt.
Systematik der Glucose
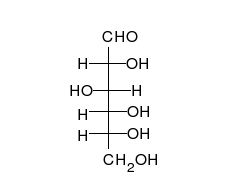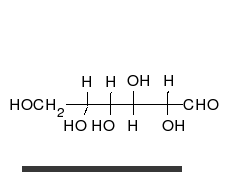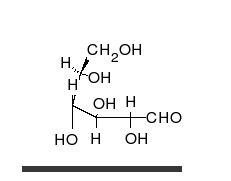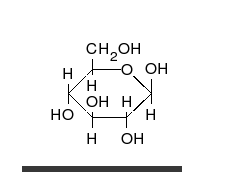
verschiedene D-Glucose – Formen und Darstellungen im Vergleich Keilstrichformel Haworth-Schreibweise 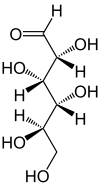
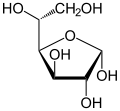
α-D-Glucofuranose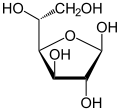
β-D-Glucofuranose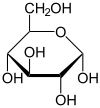
α-D-Glucopyranose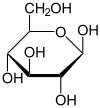
β-D-Glucopyranoseα-D-Glucopyranose in (1) Tollens/Fischer- (2) Haworth- (3) Sessel-Darstellung (4) stereochemischer Ansicht 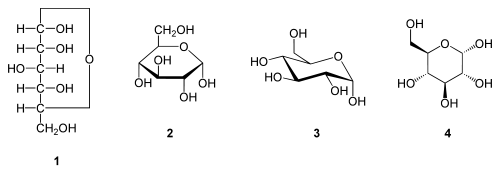
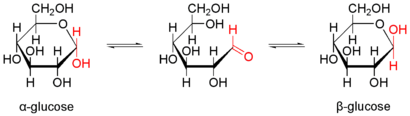
Als Kohlenhydrat mit sechs C-Atomen gehört Glucose zu den Hexosen. Als Aldose hat die Glucose eine Aldehydfunktion am ersten Kohlenstoffatom (Kohlenhydrate mit einer Ketogruppe werden als Ketosen bezeichnet). Durch eine intramolekulare Halbacetal-Bildung entsteht ein Ring: In der Pyranose-Form wird das erste mit dem fünften, in der selteneren Furanose-Form das erste mit dem vierten Kohlenstoffatom über eine Sauerstoffbrücke verbunden. Der Carbonylsauerstoff der Aldehydgruppe wird dabei zur Hydroxylgruppe.
Die oben abgebildete Darstellung der pyranoiden Form – im Beispiel die β-D-Glucopyranose (für eine Erklärung der Bezeichnungen „D“ und „L“ siehe Fischer-Projektion) – wird als Haworth-Projektion bezeichnet. Dabei wird der Ring als eben dargestellt, was nicht der Realität entspricht, aber für viele Zwecke ausreichend ist. Durch den Ringschluss wird das erste C-Atom zu einem neuen, weiteren Chiralitätszentrum, so dass die Bildung von Diastereomeren möglich wird. Die Struktur, bei der die Hydroxy-Funktion des Halbacetals in der Haworth-Projektion nach unten weist, wird als α-D-Glucose bezeichnet, die mit der Hydroxy-Funktion nach oben als β-D-Glucose. Allgemein gilt, dass bei der α-Form die beim Ringschluss gebildete Hydroxy-Funktion auf der entgegengesetzten Seite der Ringebene der Haworth-Projektion steht wie die Hydroxymethylengruppe (C-Atom 6), bei der β-Form auf derselben. In dieser Form gilt die Definition sowohl für die D- und L-Zucker, als auch für Aldosen und Ketosen. α- und β-D-Glucose sind Beispiele für als Anomere bezeichnete Strukturen. Anomere sind stereoisomere Zucker, die sich nur in der Konfiguration an dem beim Ringschluss gebilden Chiralitätszentrum unterscheiden. Anomere sind somit ein Spezialfall der Epimere.
Die Fischer-Projektion ist bei den cyclischen Halbacetal-Formen, siehe 1, unübersichtlich. Um die gewinkelte Anordnung der Kohlenstoff-Kette zu verdeutlichen wird die Sessel-Darstellung 3 gewählt. Auch die Darstellung 4 ist üblich und stereochemisch eindeutig.
Reaktionen der Glucose
Siehe auch: Kohlenhydrate: Chemie
Verhalten in wässriger Lösung
In wässriger Lösung kann der Ring geöffnet und geschlossen werden, so dass ein Gleichgewicht zwischen Pyranose- (Sechsring mit endozyklischem Sauerstoffatom, 99,75 %), Furanoseform (Fünfring, in Spuren) und offenkettiger Aldehydform (0,25 %) vorliegt. Die Zugabe von Säure oder Lauge beschleunigt diesen Vorgang. Da beim Ringschluss entweder die Alpha- oder die Beta-Form entstehen kann, liegt auch ein Gleichgewicht zwischen Alpha-Form (36,4 %) und Beta-Form (63,6 %) vor. Das Gleichgewicht liegt, wie an den prozentualen Anteilen zu erkennen ist, auf der Seite der β-D-Glucose. Sie ist das stabilere Anomer, da alle Hydroxylgruppen in der Sesselkonformation äquatorial angeordnet sind und somit den größtmöglichen Abstand voneinander haben. Dass das α-Anomer mit immerhin 36,4 % trotz der axialen OH-Gruppe vorliegt, deutet darauf hin, dass es noch weitere Einflüsse geben muss. Die relative Stabilität der α-Konfiguration wird als anomerer Effekt bezeichnet.
Mutarotation
Diese Umwandlung der beiden Formen kann im Polarimeter beobachtet werden, da reine α-D-Glucose einen spezifischen Drehwinkel von +112° hat, reine β-D-Glucose von +18,7°. Hat sich nach einer gewissen Zeit das Gleichgewicht eingestellt, liegt ein Drehwinkel von +52,7° vor. Durch Zugabe von Säure oder Base kann diese Umwandlung massiv beschleunigt werden. Die Gleichgewichtseinstellung läuft über die offenkettige Aldehyd-Form.
Isomerisierung
In verdünnter Natronlauge werden Mannose, Glucose und Fructose ineinander umgewandelt (Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung), so dass sich ein Gleichgewicht zwischen diesen Isomeren ausbildet. Diese Reaktion verläuft über ein Endiol: R-CH(OH)-CH=O
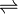 R-C(OH)=CH-OH
R-C(OH)=CH-OH 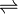 R-C(=O)-CH2-OH
R-C(=O)-CH2-OHNachweisreaktionen
Fehling-Reaktion
Der Nachweis der Aldehydgruppe in wässriger Lösung eines Gemisches aus Kupfersulfat- (Fehling I) und basischer Kalium-Natrium-Tartrat-Lösung (Fehling II) fällt positiv aus (ziegelroter Niederschlag von Kupferoxid), siehe auch Fehling-Probe.
Eine Erklärung für die positive Fehling-Reaktion der Glucopyranose ist die im Gleichgewicht zwischen α- und β-Glucose immer zu einem geringen Anteil (0,25%) vorliegende offenkettige Aldehydform.
Schiffsches Reagenz
Mit Fuchsin in Schwefliger Säure fällt der Nachweis der Aldehydgruppe negativ aus, da unter diesen Bedingungen eine Ringöffnung aufgrund der Toleranzgrenze des Versuchs nicht nachgewiesen werden kann.
Tollens-Reagenz (Silberspiegelprobe)
Das Ag+ in Silbernitrat-Lösung wird durch die Glucose zu elementarem Silber reduziert, das im Idealfall das Testgefäß mit einem Metallspiegel überzieht, siehe Tollensprobe.
Anmerkung: Ein Hinweis für die Ringform im festen Zustand sind zwei verschiedene Schmelzpunkte für reine D-Glucose. Gäbe es nur die offenkettige Aldehyd-Form, dürfte es nur einen Schmelzpunkt geben. α-D-Glucose hat einen Schmelzpunkt von 146 °C, β-D-Glucose von 150 °C.
Reaktion mit Kaliumpermanganat
In alkalischem Medium kann Glucose durch Kaliumpermanganat zur Gluconsäure oxidiert werden.
Glucose-Oxidase-Test (GOD-Test)
Das Enzym Glucose-Oxidase oxidiert Glucose zur Gluconsäure. Das dabei entstehende Wasserstoffperoxid wird in einer Farbreaktion nachgewiesen. Dieser Nachweis ist spezifisch für die Glucose.
Quantitative Bestimmung
Die quantitative Bestimmung der Glucose gelingt mittels der reduktumetrischen Methode nach Luff-Schoorl.
Glucosekonzentration im Blut
Die Glucose im Blut wird als Blutzucker bezeichnet. Der Blutzuckergehalt eines gesunden Menschen beträgt im nüchternen Zustand, d. h. nach Übernachtfasten, circa 70 bis 100 mg/dl Blut. Im Blutplasma liegen die gemessen Werte ca. 10–15 % höher. Außerdem liegen die Werte im arteriellen Blut über den Konzentrationen im venösen Blut, da Glucose während der Passage des Kapillarbettes in das Gewebe aufgenommen wird. Auch im Kapillarblut, das häufig zur Blutzuckerbestimmung verwendet wird, liegen die Werte teils höher als im venösen Blut. Nach Nahrungsaufnahme steigt die Blutzuckerkonzentration an. Werte über 180 mg/dl in venösem Vollblut sind sicher pathologisch und werden als Hyperglykämie bezeichnet. Ein wiederholt oder dauerhaft erhöhter Blutzuckerwert weist in der Regel auf Diabetes mellitus hin. Glucosekonzentrationen unter 40 mg/dl in venösem Vollblut werden als Hypoglykämie bezeichnet.[5]
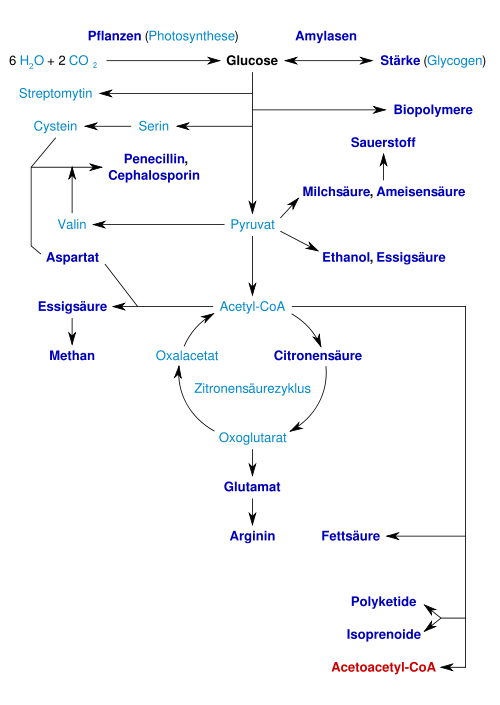
Biotechnologische Produkte aus Glucose
Glucose ist ein bedeutender biotechnologischer Rohstoff. Folgende Schautafel gibt einen kurzen Überblick über wichtige Produkte (Klick auf die Namen führt zu den entsprechenden Artikeln). Die industriell interessanten Produkte bzw. deren Vorstufen sind fett gekennzeichnet:
Merkhilfen zur Stereochemie
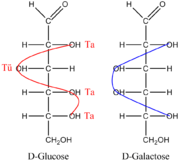
Um sich die Glucose-Konfiguration in der Fischer-Projektion zu merken, gibt es folgende Eselsbrücke: Die Positionen der Hydroxylgruppen rechts und links der Kohlenstoffkette lassen sich durch „Ta-Tü-Ta-Ta“ (wie das Martinshorn) „versinnbildlichen“. Die Anordnung der Hydroxylgruppen der Galaktose kann man sich hingegen als Blaulicht (siehe Abbildung) merken.
Siehe auch
Quellenangaben
- ↑ a b c d e Eintrag zu CAS-Nr. 50-99-7 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 29. März. 2008 (JavaScript erforderlich)
- ↑ Question No. 215 : How sweetness can be measured? Is there a simple method to measure sweetness of sugar and other type of sweeteners? Singapore Science Center, 2006
- ↑ D-Glucose in der Seilnacht Chemikaliendatenbank Thomas Seilnacht, 5. Februar 2009
- ↑ Sicherheitsdatenblatt Carl Roth
- ↑ W. A. Scherbaum, B. M. Lobnig, in: Wolff, Weihrauch: Internistische Therapie, 16. Auflage, Elsevier, München S. 927 u. S. 985
Literatur
- Jochen Lehmann: Kohlenhydrate. Chemie und Biologie. 2. neu bearb. und erw. Aufl., Thieme, Stuttgart; New York 1996
- Stefan Schenk: Glucose. Der Energielieferant des Körpers. 1. Aufl. München, 2001
Wikimedia Foundation.