- Chromsäure
-
Strukturformel 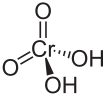
Allgemeines Name Chromsäure Andere Namen Dihydrogentetraoxochromat (IUPAC)
Summenformel H2CrO4 CAS-Nummer 7738-94-5 Kurzbeschreibung dunkelrote bis gelbe geruchlose wässrige Lösung[1]
Eigenschaften Molare Masse 116,95 g·mol–1 Aggregatzustand nur als Lösung in Wasser beständig
Dichte 1,5 g·cm–3 (50 % CrO3)[1]
Siedepunkt thermische Zersetzung [1]
Löslichkeit CrO3 gut löslich in Wasser: 1854 g·l−1 (bei 20°C) [1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] stellvertretend für Chrom(VI)-oxid





Gefahr
H- und P-Sätze H: 271-350-340-361f-330-311-301-372-314-334-317-410 EUH: keine EUH-Sätze P: 201-273-280-301+330+331-304+340-305+351+338-309-310 [1] EU-Gefahrstoffkennzeichnung [1] 


Brand-
förderndSehr giftig Umwelt-
gefährlich(O) (T+) (N) R- und S-Sätze R: 45-46-9-24/25-26-35-42/43-48/23-50/53-62 S: 53-45-60-61 MAK aufgehoben, da karzinogen [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Chromsäure mit der Struktur H2CrO4 existiert nur in verdünnten wässrigen Lösungen. Reine, wasserfreie Chromsäure ist unbekannt. Sie ist eine starke zweiprotonige Säure und bildet als Salze die Chromate. Hydrogenchromate sind hingegen instabil und nur in wässriger Lösung bekannt.
Wird Chromsäure als Feststoff angeboten, handelt es sich stets um das Anhydrid der Chromsäure, das Chromtrioxid. Ebenso wie das Anhydrid ist die Chromsäure ätzend und giftig.
Inhaltsverzeichnis
Wässrige Lösung
Chromsäure ist eine starke Säure (pKs-Wert: −0,61) und liegt im Gleichgewicht nur zu einem sehr geringen Teil als H2CrO4 vor. HCrO4− ist hingegen eine schwache Säure (pKs-Wert: 6,45).[3] Daher liegt Chromsäure in verdünnter wässriger Lösung überwiegend als Hydrogenchromat HCrO4− vor.
Werden die wässrigen Lösungen mit einer Base versetzt, liegen bei einem pH-Wert > 7 überwiegend CrO42−-Ionen vor.
Bei pH-Werten zwischen 2 und 6 liegen HCrO4− vor und es bilden sich in einer Gleichgewichtsreaktion Dichromate (Cr2O72−). Bei dieser Reaktion kommt es zu einem Farbumschlag von gelb nach orange. Ist der pH-Wert der Lösung < 1, bilden sich unter weiterer Farbvertiefung Polychromate der allgemeinen Formel CrnO3n+12−.
Verwendung
Chromsäure wird in der Chemie als Oxidationsmittel eingesetzt. Mit ihr lassen sich primäre Alkohole zu Aldehyden bzw. zu Carbonsäuren, sekundäre Alkohole zu Ketonen oxidieren. In der Industrie wird Chromsäure zur Passivierung galvanisch erzeugter Schichten (vor allem von Cadmium) und zur Vorbehandlung von Aluminiumoberflächen (anodische Oxidation) verwendet. Sie wird ebenfalls (über Chromtrioxid) zur Herstellung von Kaliumdichromat, Ammoniumdichromat und Chromdioxid verwendet.
Chromsäure ist nicht zu verwechseln mit der Chromschwefelsäure.
Toxikologie
Chrom(VI)-Verbindungen sind äußerst giftig (die letale Dosis entspricht einem halben Teelöffel) und auch seit langem als krebserregend bekannt. Bei Hautkontakt erzeugen die Verbindungen Irritationen an Augen, Haut und Schleimhäuten. Chronischer Kontakt mit Chrom(VI)-Verbindungen kann bei unterlassener Behandlung zu bleibenden Augenschäden führen.
Seit 1958 empfiehlt die WHO (World Health Organization) für Chrom(VI)-Verbindungen eine maximal zulässige Konzentration von 0,05 mg/Liter im Trinkwasser.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Chromsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Januar 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 1333-82-0 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Holleman–Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, 2007, S. 1568
Literatur
Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, S. 1567–1569, ISBN 978-3-11-017770-1.
Kategorien:- Krebserzeugender Stoff
- Erbgutverändernder Stoff
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Giftiger Stoff
- Sensibilisierender Stoff
- Brandfördernder Stoff
- Umweltgefährlicher Stoff
- Anorganische Säure
- Chromverbindung
- Sauerstoffverbindung
Wikimedia Foundation.
