- Glycidol
-
Strukturformel 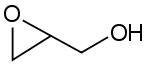
Allgemeines Name Glycidol Andere Namen - 2,3-Epoxi-1-propanol
- Glyceringlycid
Summenformel C3H6O2 CAS-Nummer - 556-52-5 (Racemat)
- 57044-25-4 [(R)-Isomer]
- 60456-23-7 [(S)-Isomer]
PubChem 11164 Kurzbeschreibung farb- und geruchlose Flüssigkeit[1]
Eigenschaften Molare Masse 74,08 g·mol−1 Aggregatzustand flüssig
Dichte 1,1143 g·cm−3 (Racemat)[2]
Schmelzpunkt −54 °C[1]
Siedepunkt 162–163 °C (Zersetzung)[1]
Dampfdruck Löslichkeit Brechungsindex 1,433 bei 20°C[5]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [6] 

Gefahr
H- und P-Sätze H: 350-341-360F-331-312-302-319-335-315 EUH: keine EUH-Sätze P: 201-261-280-305+351+338-311 [5] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [6] 
Giftig (T) R- und S-Sätze R: 45-60-21/22-23-36/37/38-68 S: 53-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Glycidol ist eine organische chemische Verbindung aus den Gruppen der Epoxide (Oxirane) und der Alkohole. Die Substanz ist eine klare, geruch- und geschmacklose Flüssigkeit, die langsam mit Wasser zu Glycerin reagiert. Das Glycidolmolekül ist chiral und kommt daher in zwei verschiedenen, spiegelbildichen Enantiomeren vor.
Inhaltsverzeichnis
Herstellung
Racemisches Glycidol lässt sich durch Dehalogenierung und Epoxidbildung aus 1-Chlor-propandiol mit Basen gewinnen. Aus Allylalkohol und [tert-Butylhydroperoxid lässt sich stereospezifisch bei Anwesenheit von Titantetraethanolat oder Titantetraisopropanolat und Diethyltartrat das (S)-Enantiomer darstellen.[7]
Reaktionen
Durch Reaktion der Epoxigruppe kann Glycidol eine Vielzahl von Reaktionen mit Nukleophilen eingehen. Mit Alkoholen bilden sich über Ringöffnung Ether. Über die OH-Gruppe können sowohl Ester als auch Ether entstehen.
Verwendung
Glycidol wird als Stabilisator für Pflanzenöle und Vinyl-Polymere und zur Entmischung von Emulsionen eingesetzt.[8] Weiterhin dient es zur Herstellung von Tensiden, Arzneimitteln, Kunstharzen und Ausrüstungsmitteln für Textilien. Auf Glycidol basierende Ether kommen als Reaktivverdünner für Lacke zum Einsatz.
Sicherheitshinweise
In Gegenwart geeigneter Katalysatoren kann Glycidol explosionsartig polymerisieren. Der Stoff ist krebserregend, reizt stark die Schleimhäute und die Haut und verursacht bei Kontakt durch Verletzung der Hornhaut schwere Augenschäden. Das zentrale Nervensystem kann stimuliert werden, bei anschließender möglicher Depression. Im Tierversuch mit Ratten und Mäusen erwies sich Glycidol als genotoxisch, carcinogen und erzeugte verringerte Fertilität bis hin zur Sterilität.[9]
In Baden-Württemberg wurden in pflanzlichen Speiseölen wie Palmöl Glycidol-Fettsäureester gefunden, die bei der Raffination entstehen können. Diese Ester hydrolysieren im menschlichen Verdauungstrakt zu Fettsäuren und Glycidol. Deshalb rät das BfR von der Verwendung von Palmöl-haltiger Babynahrung ab.[10]
Einzelnachweise
- ↑ a b c d Eintrag zu Glycidol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19.10.2009 (JavaScript erforderlich)
- ↑ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 775−776, ISBN 978-0-911910-00-1.
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics. 85. Auflage, 2005, CRC Press, Kap. 3, S. 444.
- ↑ Glycidol. In: Römpp Chemie-Lexikon, Thieme Verlag, Stand März 2002.
- ↑ a b Datenblatt Glycidol bei Sigma-Aldrich, abgerufen am 3. April 2011.
- ↑ a b Eintrag zu CAS-Nr. 556-52-5 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Leo A. Paquette: Handbook of Reagents for Organic Synthesis: Chiral reagents for asymmetric synthesis.John Wiley and Sons, 2003, ISBN 978-0-470-85625-3, S. 345.
- ↑ Jeffrey W. Vincoli: Risk management for hazardous chemicals. Band 2, CRC Press, 1997, ISBN 978-1-56670-200-3, S. 1563.
- ↑ BauA: 2,3-Epoxypropan-1-ol (Glycidol).
- ↑ Fragen und Antworten zu Glycidol-Fettsäureestern FAQ des BfR vom 30. April 2009.
Literatur
- Beilsteins Handbuch der Organischen Chemie E, III/IV, 17: 985
- D'ans Lax: Taschenbuch für Chemiker und Physiker. Band 2 Organische Verbindungen 4. Auflage, 1983
Kategorien:- Krebserzeugender Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff
- Giftiger Stoff
- Alkohol
- Epoxid
Wikimedia Foundation.
