- Schweinegrippe-Impfung
-
Als Schweinegrippe-Impfung wird die Impfung gegen die pandemische (H1N1) 2009-Influenza (Neue Grippe) bezeichnet. Die Impfung richtet sich gegen das Influenza-A-Virus H1N1 des „Virusstammes“[1] A/California/7/2009 (H1N1).[2] In der aktuellen[3] offiziellen Nomenklatur für Deutschland (ICD-10-GM Version 2010) wird die nachgewiesene Erkrankung unter „J09 Grippe [..]“ eingeordnet und „Influenza A/H1N1 Pandemie 2009 [Schweinegrippe]“ benannt.[4][5]
Die in diesem Artikel beschriebenen Pandemieimpfstoffe dürfen nur im Rahmen der offiziell erklärten pandemischen Situation angewendet werden. In der Europäischen Union sind bisher vier derartige Impfstoffe zugelassen.
Die Anwendung erfolgt meist durch Spritzen in einen Muskel (intramuskuläre Injektion); das in den USA erhältliche MedImmune Influenza A (H1N1) 2009 wird in die Nase getropft. Die Wirkung dieser Impfstoffe beruht darauf, das Immunsystem des Körpers durch die Gabe von abgeschwächten oder inaktivierten Viren oder Teilen davon zur Bildung von Antikörpern anzuregen, ohne dabei eine Erkrankung auszulösen.
Inhaltsverzeichnis
Impfstoffvorbereitung
Der für die Grippesaison 2009/2010 vorgesehene saisonale Influenza-Impfstoff wurde nach entsprechenden Untersuchungen als nicht oder nur unzureichend wirksam gegen den Erreger der Schweinegrippe eingestuft. [6] Er wurde aber dennoch produziert, da im Frühsommer 2009 noch nicht absehbar war, ob der neue Erreger bis zur Grippesaison über die saisonalen Erreger dominieren würde.[7] Deshalb erfolgte mit den noch zur Verfügung stehenden „freien“ Kapazitäten die Entwicklung und Produktion von an den speziellen Erreger der Schweinegrippe angepassten Impfstoffen.
Impfaktion
Da die Ausbreitung des Schweinegrippe-Erregers nicht mehr gestoppt und ein angepasster Impfstoff voraussichtlich nicht für die gesamte Bevölkerung rechtzeitig produziert werden könne, empfahl die WHO Mitte Juli 2009 allen Mitgliedsländern, mit oberster Priorität das medizinische Personal zu impfen, um die Funktionsfähigkeit des Gesundheitssystems aufrechterhalten zu können.[7] Zugleich wurde es den nationalen Behörden überlassen, bestimmte Gruppen vorrangig zu impfen: Kinder und Jugendliche, die das Virus schnell verbreiten, oder Personen unter 50 Jahren, die eine geringere natürliche Immunität gegen dieses Virus besitzen, oder besondere Risikogruppen, wie Schwangere, Kleinkinder ab sechs Monaten, ältere Menschen oder Menschen mit chronischen Atemwegserkrankungen oder großem Übergewicht. Auf Grund neuerer Daten (24. November 2009) spricht das Robert Koch Institut von keinen Hinweisen für ein vermehrtes Auftreten schwerer unerwünschter Wirkungen bei den bislang stattgefundenen Impfungen.[8]
In der Europäischen Union zugelassene Impfstoffe
In der Europäischen Union sind vier Impfstoffe zugelassen (Stand: 9. Oktober 2009):[2]
Name Hersteller Kurzbeschreibung Pandemrix GlaxoSmithKline aus Bruchteilen von Virenhüllen von in bebrüteten Hühnereiern gezüchteten Viren (Teilpartikelimpfstoff) mit Wirkverstärker hergestellt Focetria Novartis aus Bruchteilen von Virenhüllen von in bebrüteten Hühnereiern gezüchteten Viren (Teilpartikelimpfstoff) mit Wirkverstärker hergestellt Celvapan Baxter aus kompletten Virenhüllen von in Säugetierzellen (Vero-Zellen) gezüchteten Viren (inaktivierter Ganzpartikelimpfstoff) ohne Wirkverstärker hergestellt Celtura Novartis-Behring aus Bruchteilen von Virenhüllen von auf Zellkulturbasis gezüchteten Viren (Teilpartikelimpfstoff) mit Wirkverstärker hergestellt Davon wurden Focetria, Pandemrix und Celvapan seit dem 1. Oktober 2009 von der europäischen Arzneimittelagentur auf dem Gebiet der EU zur Verwendung empfohlen.[9]
Zulassungsverfahren
Europäische Union
Die europäische Arzneimittelagentur der Europäischen Union (EU) hat für die Zulassung von Impfstoffen, die für die Eindämmung einer Pandemie verwendet werden sollen, verschiedene besondere Verfahren ("authorisation procedures") vorgesehen.[10]
Durch diese besonderen Zulassungsverfahren soll erreicht werden, dass ein Grippeimpfstoff schneller zugelassen werden kann als erst nach 18 bis 24 Monaten, die normalerweise eine Zulassung einer Arznei in der EU benötigt.[10]
Die europäische Arzneimittelagentur sieht folgende drei Zulassungsverfahren vor: "mock-up authorisation procedure" (etwa: Verfahren der Imitationsimpfstoffe oder Modellimpfstoff-Verfahren), "emergency authorisation procedure" (etwa: Notfall-Zulassungsverfahren oder beschleunigtes Zulassungsverfahren) und "modification of seasonal flu vaccines" (etwa: Modifikation/Veränderung saisonaler Grippeimpfstoffe).[10]
Modellimpfstoff-Verfahren
Ein Modellimpfstoff ist ein Impfstoff, der schon entwickelt wurde, bevor eine Pandemie beginnt.[11] Da aber der Virusstamm, der die Pandemie verursachen wird, zu dieser Zeit noch nicht bekannt ist, können Unternehmen noch nicht beginnen, einen Impfstoff herzustellen, der das korrekte Virus enthält.[11] Um dieses Problem zu umgehen, erlaubt das Modellimpfstoff-Verfahren ("mock-up procedure" oder "‘core dossier’ procedure") Herstellern, eine Zulassung für Modellimpfstoff oder Prototypimpfstoff schon vor einer Pandemie zu erhalten.[11] Dieses Vorgehen wird einzig für Pandemieimpfstoffe angewendet.[11]
Nach den von der europäischen Arzneimittelagentur festgelegten Kriterien muss unter Anderem ein wirksamer Modellimpfstoff bei mindestens 70 % der Geimpften schützende Antikörperspiegel induzieren.[12][13]
Immunverstärker
Die meisten der in der Europäischen Union zugelassenen Impfstoffe enthalten so genannte Adjuvanzien (auch Wirkungsverstärker, Booster, Immunverstärker genannt). Der Einsatz dieser pharmazeutischen Hilfsstoffe in Pandemieimpfstoffen wird begründet mit der Verstärkung der immunologischen Reaktion, die es ermöglicht, die erforderliche Antigenmenge einer Impfdosis zu reduzieren und die zu einer Kreuzimmunität gegen ein verändertes Pandemievirus beitragen soll.[12] Die Weltgesundheitsorganisation WHO hat sich für den Einsatz von Adjuvanzien ausgesprochen, weil dadurch nur ein Bruchteil der Antigen-Dosis notwendig sei und nur somit in vertretbarer Zeit ausreichend Impfstoff für eine große Zahl zu Impfender herzustellen sei.[14]
In den USA sind bisher fünf Impfstoffe zugelassen, die von den Unternehmen CSL, MedImmune[15], Novartis Vaccines, Sanofi-Pasteur und GlaxoSmithKline (GSK)[16] stammen. Sie enthalten keine Immunverstärker.[17][16] Insgesamt wurden von der amerikanischen Regierung 250 Millionen Impfdosen dieser Art bestellt, von denen etwa 40 Millionen bis Anfang November zur Verfügung stehen werden. [18] Die aktuelle Situation zur Impfstoffverfügbarkeit und zu Sicherheitsaspekten der Impfstoffe in den USA wird in der FDA-Medwatch-Meldung vom 10. November 2009 von Commissioner Margaret A. Hamburg dargestellt.[19]
In Europa wurde nach größeren Ausbrüchen der Vogelgrippe entschieden, im Falle einer Pandemie anders vorzugehen als bei der saisonalen Grippeimpfung. [20] Begründet war dies in dem Wunsch, in möglichst kurzer Zeit möglichst viele Menschen schützen zu können.[20]
In der Europäischen Union sind derzeit vier Impfstoffe zugelassen.[21] Zwei dieser Impfstoffe (Pandemrix und das in Deutschland nicht angeforderte Focetria) sind aus Virusteilen (Virushülle) hergestellt (Spaltvakzine, oder Teilpartikelimpfstoffe) und mit Immunverstärkern versehen.
Das Paul-Ehrlich-Institut (PEI), das deutsche Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, hält die Adjuvanzien für sinnvoll. Es gebe langjährige Erfahrungen in der Anwendung von Grippeimpfstoffen, die das Adjuvans MF59 enthielten, ohne gravierende Nebenwirkungen. Das Adjuvans AS03, welches der aktuell von den Bundesländern georderte Impfstoff enthalte, sei neu, aber an vielen tausend Personen klinisch geprüft worden. Bei den Adjuvanzien werden allerdings Lokalreaktionen an der Impfstelle sowie Kopf- und Gliederschmerzen heftiger sein. Da aus ethischen Gründen keine Tests an Schwangeren erfolgten, lägen keine konkreten Daten dazu vor. [22] [23] [20] [24] [25]
Kritik
Einige Fachleute sehen die Verwendung der Impfstoffe mit Adjuvanzien kritisch. Die Arzneimittelkommission der deutschen Ärzteschaft und die Ständige Impfkommission empfehlen, dass den Gruppen, für die keine ausreichenden Daten zur Sicherheit vorliegen, ein nicht adjuvanzierter Impfstoff angeboten wird. In den USA werden ausschließlich Impfstoffe eingesetzt, die frei von Adjuvanzien sind.[17] Gefürchtet werden zum Beispiel die (sehr seltenen) neurologischen Schäden durch Attacken des Immunsystems auf Spinalganglien und periphere Nerven nach Impfung (Guillain-Barré-Syndrom).[26]
Vom deutschen Berufsverband der Kinder- und Jugendärzte (BVKJ) wurde gefordert, dass für Kinder zukünftig A/H1N1-Impfstoffe entwickelt werden, die frei von Adjuvanzien und dem Konservierungsstoff Thiomersal sind.[27]
Das deutsche Bundesministerium für Gesundheit verhandelt derzeit mit internationalen Herstellern noch über einen Spaltimpfstoff ohne Wirkverstärker, der konventionell in Hühnereiern angezüchtet wurde. [28]
Im Mittelpunkt verschiedener Meldungen stand das im Adjuvans AS03 enthaltene Squalen. Das Paul-Ehrlich-Institut stellte hierzu klar, dass es keinen Grund dafür gebe, Squalen als Auslöser des sogenannten Golfkriegssyndroms zu fürchten. Es wies insbesondere darauf hin, dass sich die Studie, auf die sich diese Meldungen berufen, als nicht aussagekräftig (valide) erwiesen habe. Antikörper gegen Squalen würden auch natürlicherweise in der amerikanischen Bevölkerung vorkommen. Nach einer späteren aussagekräftigen Studie sei bei den Soldaten, die über das sogenannte Golfkriegssyndrom klagten, der Anteil mit solchen Antikörpern nicht erkennbar höher als bei solchen ohne diese Beschwerden.[29]
Konservierungsstoffe
Impfstoffe werden für Massenimpfungen häufig in Mehrfachgebinden geliefert. Sie beanspruchen möglichst wenig Kühlkapazität bei Transport und Lagerung und können im Pandemiefall schneller produziert werden als Fertigspritzen[30], müssen allerdings konserviert werden. Zur Konservierung dient Thiomersal. Diese Quecksilberverbindung wird bei Vakzinen für Kleinkinder seit einigen Jahren nicht mehr verwendet. Nach Angaben der europäischen Arzneimittelagentur sind bis zu fünf Prozent der Bevölkerung gegen die Verbindung allergisch. Deutliche Symptome entwickelt jedoch nur jeder Zehnte dieser Gruppe.[14]
Einzelimpfstoffe
Pandemrix
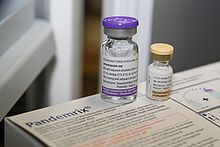
Pandemrix (Hersteller GlaxoSmithKline) wurde auf der Basis des aviären Influenza-A-Virus H5N1 entwickelt und von der europäischen Arzneimittelagentur zugelassen.[31] Der Impfstoff ist ein auf der Basis von Hühnereiern hergestelltes Spaltvakzin (Teilpartikelimpfstoff).
Zwei getrennt abgefüllte Flüssigkeiten werden vor der Verabreichung im Durchstechfläschen zur injektionsfertigen Dispersion vermischt. Ein Teil beinhaltet die Antigensuspension, welche 3,75 Mikrogramm Viruspartikel pro Impfdosis enthält. Dies entspricht einem Viertel der Partikelmenge, welche in der Regel bei Impfungen gegen die saisonale Grippe je Virustyp verabreicht wird. Auch stellt dies die geringste Konzentration von Viruspartikeln dar, welche derzeit in Grippeimpfstoffen zur Anwendung kommt. Um deshalb die Wirksamkeit des primären Impfstoffes zu erhöhen, besteht der andere Teil aus einer Emulsion, welche das Adjuvans AS03 enthält.[1] In den Vereinigten Staaten ist AS03 nur für Patienten über 65 Jahre zugelassen.[32] Weiterhin enthält der im Mehrdosisbehältnis abgepackte Impfstoff 5 µg/Dosis Thiomersal als Konservierungsstoff. Die Aufbrauchfrist beträgt 24 Stunden.
In Deutschland legten das Bundesministerium für Gesundheit und die Bundesländer Ende 2007 mit GlaxoSmithKline vertraglich fest, im Fall einer Influenza-Pandemie den neuartigen Impfstoff Pandemrix mit dem Wirkverstärker AS03 zu kaufen.[33][17] Von den deutschen Bundesländern wurden 2009 50 Millionen Dosen von Pandemrix bestellt.
In Schweden wurden etwa 100 Millionen Euro für eine Impfkampagne für die etwa 9,2 Millionen Einwohner verplant. [34]
Laut europäischer Arzneimittelagentur sind im Rahmen von klinischen Studien mit dem entsprechenden Muster-Impfstoff bei mehr als 10 Prozent der Geimpften folgende Nebenwirkungen beobachtet worden: Kopfschmerzen; Müdigkeit; Schmerzen, Rötung, Schwellung oder Verhärtung an der Injektionsstelle; Fieber; Muskel- und Gelenkschmerzen; bei mehr als einem Prozent: Wärme, Juckreiz oder Blutergüsse an der Injektionsstelle; verstärktes Schwitzen, Schüttelfrost, grippeähnliche Symptome; Lymphknotenschwellung an Nacken, Achsel oder Leiste.[35] Weitere Angaben zu diesen und weiteren, nicht häufig zu erwartenden Nebenwirkungen sowie Verhaltensanweisungen enthält die (im Internet zugängliche)[36] Packungsbeilage für Pandemrix.
In Schweden wurde am 29. Oktober 2009 ein erster Bericht über Verdachtsfälle von unerwünschten Reaktionen nach der Impfung mit Pandemrix veröffentlicht.[37] Beachtenswert ist die Meldung von allergischen Reaktionen bei 37 Patienten, darunter 15 schwerwiegende Reaktionen. Nach Angaben der schwedischen Behörde wurden vier anaphylaktische Reaktionen in ursächlichem Zusammenhang mit der Impfung berichtet. In keinem Fall kam es zu einem anaphylaktischen Schock.[38] Es ist nicht bekannt, wie viele Dosen verimpft wurden.
Das Paul-Ehrlich-Institut veröffentlichte eine „Information zu Verdachtsfallberichten von Nebenwirkungen und Impfkomplikationen nach Anwendung des in Deutschland zugelassenen Schweinegrippe (H1N1)-Impfstoffs Pandemrix“.[39] Sie bezieht sich auf die zwei Wochen bis zum 5. November 2009, 17 Uhr. Danach sind aus Deutschland bei einer nicht genannten Zahl an Impfungen 59 Verdachtsfälle gemeldet worden. Hinweise auf eine allergische Reaktion bzw. Überempfindlichkeitsreaktion gab es bei sieben Personen. Eine anaphylaktische Reaktion sei in zwei Fällen gemeldet worden. Bei einem dieser Fälle sei ein Zusammenhang mit der Impfung wahrscheinlich, bei dem anderen Fall müssten noch weitere Informationen eingeholt werden.[39]
Einige der oben erfassten Fälle von Nebenwirkungen wurden als Narkolepsie diagnostiziert. Bisher sind - weltweit, bei bisher 31 Millionen verabreichter Dosen des Impfstoffes - 161 Fälle (Berichtsstand Januar/Februar 2011) von Narkolepsie in Verbindung mit der Pandemrix-Impfung aufgetreten, davon 70 Prozent in Schweden und Finnland, aber auch sieben Fälle in Deutschland, vor allem bei Kindern im Alter von vier bis 19 Jahren.[40][41][42]
In der Schweiz darf Pandemrix nicht bei Schwangeren und bei Kindern unter sechs Monaten verabreicht werden.[43] Für Menschen über 60 Jahre wurde die Anwendung am 19. November 2009 zugelassen, da belegt sei, dass der Impfstoff auch in dieser Bevölkerungsgruppe wirksam sei.[44]
Nach Angaben der europäischen Arzneimittelagentur vom 4. Dezember 2009 löst die zweite Dosis des Impfstoffes Pandemrix® bei Kindern unter 3 Jahren häufig eine Fieberreaktion aus. Es wird dennoch kein Anlass gesehen, von der Verabreichung der bei dieser Impfung üblichen zweiten Impfdosis abzuraten.[45][46]
Focetria
Focetria (Hersteller Novartis) ist ein auf der Basis von Hühnereiern hergestellter Teilpartikelimpfstoff und enthält das Adjuvans MF59. Die Genehmigung für das Inverkehrbringen von Focetria wurde am 2. Mai 2007 von der Europäischen Kommission in Verbindung mit dem aviären Influenza-A-Virus H5N1 erteilt. 2009 wurde das Präparat auf H1N1 umgestellt.
In klinischen Studien an (auch älteren) Erwachsenen sind in Verbindung mit Focetria folgende Nebenwirkungen in 10 von 100 Fällen oder öfter („sehr häufig“) aufgetreten: Schmerzen, Reaktionen an der Injektionsstelle (Rötung, Schwellung, Verhärtung, Bluterguss und Schmerzen), schmerzende Muskeln (Myalgie), Kopfschmerzen, Schwitzen, Erschöpfung, allgemeines Unwohlsein und Schüttelfrost; in 1 bis 10 von 100 Fällen („häufig“): Bluterguss an der Injektionsstelle, Fieber und Übelkeit.[47] Weitere, gelegentlich oder selten auftretende Nebenwirkungen bei Erwachsenen, Nebenwirkungen in klinischen Studien bei Kindern und Jugendlichen sowie weitere Hinweise finden sich in der im Internet zugänglichen Packungsbeilage.[47]
Celvapan
Celvapan (Hersteller Baxter) enthält abgetötete Vollviren (inaktivierter Ganzpartikelimpfstoff) ohne Adjuvans. Die in Celvapan enthaltenen Viren werden in Vero-Zellen gezüchtet – einer Zelllinie, die 1962 von Grünen Meerkatzen abgeleitet wurde. Das Verfahren wurde entwickelt, weil es vor dem Hintergrund der Vogelgrippe möglich wäre, dass Hühnereier knapp würden.[48]
Das deutsche Bundesministerium des Innern hat 200.000 Dosen von Celvapan bestellt.[49]
Der Berufsverband der Kinder- und Jugendärzte veröffentlichte Kritik an Erwägungen, Celvapan statt Pandemrix bevorzugt für Kinder und Schwangere einzusetzen, da keine Daten vorlägen.[50]
In früheren klinischen Studien mit „Celvapan (H5N1)“ an Erwachsenen, einschließlich älterer, traten „sehr häufig“ (bei über 10 Prozent) als Nebenwirkung Schmerzen an der Injektionsstelle auf und lediglich „häufig“ (bei 1 bis 10 Prozent): eine laufende Nase und Halsschmerzen; Kopfschmerzen, Schwindel, Drehschwindel (Bewegungskrankheit); übermäßiges Schwitzen, Gelenk- oder Muskelschmerz; Schüttelfrost, Ermüdung (Müdigkeitsgefühl), Unwohlsein (allgemeines Krankheitsgefühl), Fieber; Gewebeverhärtung, Rötung, Schwellung oder Bluterguss an der Injektionsstelle.[51] Weitere, weniger oft vorkommende Nebenwirkungen werden in der (im Internet zugänglichen) Packungsbeilage auch genannt.[51] Laufende klinische Studien (auch an Kindern) mit dem aktuellen „Celvapan (H1N1)“ gegen die sogenannte „Schweinegrippe“ bestätigen diese Erwartung in Hinblick auf Nebenwirkungen bislang.[1][52]
Celtura
Celtura (Hersteller: Novartis) ist ein auf der Basis von Zellkulturen hergestellter Teilpartikelimpfstoff mit Adjuvanz. Dieser Impfstoff stellt durch seine Herstellung auf Zellkulturbasis eine Alternative für Hühnereiweiß-Allergiker dar und ist in Deutschland und in der Schweiz zugelassen. Er enthält als Wirkstoff 3,75 µg Antigen und als Adjuvans 0,125 ml MF59 pro Dosis. Er wird in Mehrfachampullen angeboten sowie in Fertigspritzen mit je einer Dosis. Mehrfachgebinde enthalten als Konservierungsstoff Thiomersal.
Bei klinischen Studien mit mehr als 1850 Probanden seien die Verträglichkeit und Immunogenität belegt. So reiche die einmalige Impfung bei 3- bis 50-Jährigen für einen ausreichenden Schutz gegen die Schweinegrippe. Die nach Herstellerangaben bisher noch sehr begrenzten Erfahrungen zeigen als Nebenwirkungen häufig bis sehr häufig: Kopfschmerzen, Schwitzen, Gelenk- und Muskelschmerzen, Rötungen, Schwellungen, Verhärtungen, Blutergüsse und Schmerzen an der Injektionsstelle, Fieber, allgemeines Krankheitsgefühl, Erschöpfung und Frösteln. Diese Reaktionen klingen im Allgemeinen innerhalb von 1–2 Tagen ohne Behandlung wieder ab. Im Rahmen der klinischen Studien seien bisher keine schweren Nebenwirkungen beobachtet worden.[53][54][55]
Panenza
Panenza (Hersteller: Sanofi Pasteur MSD) ist ein auf der Basis von Hühnereiern hergestellter Teilpartikelimpfstoff und enthält weder Konservierungsmittel noch Adjuvanzien.[56] Als Wirkstoff kommt ein Spaltvirus 15 µg/Dosis in Anwendung. [56]Für Frankreich wurde der Impfstoff bereits zugelassen.[57]
Panvax
Panvax (Hersteller: CSL Biotherapies), auch bekannt unter dem Namen CSL H1N1 [58] , ist ein auf der Basis von Hühnereiern hergestellter Teilpartikelimpfstoff ohne Adjuvanzien, den es sowohl als Mehrfachgebinde als auch in Einzeldosen gibt. Zur Verteilung in Mehrfachgebinden enthält er das Konservierungsmittel Thiomersal.[59] Als Wirkstoff kommt ein Spaltvirus 15 µg/Dosis in Anwendung.[60]
Für Deutschland sollen 150.000 Dosen bestellt werden, um damit ein Drittel der Schwangeren impfen zu können.[61] Voraussichtlich wird dieser Impfstoff im Dezember zur Verfügung stehen und zugelassen sein.[62] Er wird in Fertigspritzen (Einzeldosen) ohne Thiomersal und Formaldehyd zur Verfügung stehen.[60][59]
MedImmune Influenza A (H1N1) 2009 Monovalent Vaccine Live, Intranasal
In den USA steht ein in die Nase (intranasal) zu verabreichender Lebendimpfstoff des Herstellers MedImmune zur Verfügung. Mit einem speziellen Applikator werden 0,1 ml Impfstoff in jedes Nasenloch appliziert. Der Impfstoff ist vorgesehen für die Altersklassen 2–9 Jahre (zwei Impfdosen im Abstand von etwa einem Monat) und 10–49 Jahre (eine Impfdosis). In der Gebrauchsinformation des Herstellers werden mögliche unerwünschte Wirkungen der Impfung aufgelistet, die in klinischen Studien ermittelt wurden.[63]
Weblinks
- Europäische Arzneimittelagentur: Vaccines (auf Englisch) verknüpft mit Information (auf Deutsch und anderen 21 EU-Sprachen) zu Celvapan, Focetria und Pandemix
- RKI: Empfehlung und Begründung zur Impfung gegen die Neue Influenza A (H1N1). Epidemiologisches Bulletin 41/2009
- Arzneimittelkommission der deutschen Ärzteschaft: Pandemische Influenza-Impfstoffe A/H1N1: Celvapan®, Focetria®, Pandemrix®. Neue Arzneimittel, Stand: 4. November 2009
- Übersicht: Pandemische Influenzaimpfstoffe des Paul Ehrlich Instituts
- Ausführliches Interview zu Fragen der Schweinegrippe-Impfung mit dem Vizepräsidenten der Bundesärztekammer, Frank Ulrich Montgomery, vom 14. November 2009 (Clixoom – Die Online-Talkshow, YouTube, 32:27 min.)
Weitere Informationen
Durch das deutsche Bundesministerium für Gesundheit, zusammen mit der Bundeszentrale für gesundheitliche Aufklärung und dem Paul-Ehrlich-Institut sind verschiedene Informationsschriften bezüglich des Impfstoffs, der Impfung selbst, Informationen zum persönlichen Grippeschutz sowie allgemeine Informationen im Internet eingestellt worden.
- Informationen zur neuen Grippe ("Schweinegrippe") des BMG
- Direkter Link zu den o. a. Informationsschriften
Einzelnachweise
- ↑ a b c Neues Grippevirus: Influenza A/H1N1. Bundesministerium für Gesundheit, Wien, abgerufen am 10. November 2009 (unter www.bmgfj.gv.at): „Die neue pandemische Grippe wird durch einen bislang unbekannten Virusstamm des Subtyps A/H1N1 verursacht.“
- ↑ a b K. Johansen, A. Nicoll, B. C. Ciancio, P. Kramarz: Pandemic influenza A(H1N1) 2009 vaccines in the European Union. In: Eurosurveillance, Volume 14, Issue 41. European Centre for Disease Prevention and Control (ECDC), 15. Oktober 2009, archiviert vom Original, abgerufen am 10. November 2009 (englischsprachig, Date of submission: 09 October 2009).
- ↑ ICD-10-GM 2010 tritt voraussichtlich am 1. Januar 2010 in Kraft. Seit ICD-10-GM Version 2004 gelten die Versionen jeweils im Jahr, das dem Namen entspricht, siehe Geltungszeiten der Klassifikationen ICD-10, OPS und ATC/DDD sowie von MeSH in Deutschland (Stand 01.12.2008). DIMDI Deutsches Institut für Medizinische Dokumentation und Information, abgerufen am 20. November 2009 („Letzte Änderung: 12.12.08 verkri“).
- ↑ Kapitel X Krankheiten des Atmungssystems (J00-J99) : Grippe und Pneumonie (J09-J18). In: ICD-10-GM Version 2010. DIMDI Deutsches Institut für Medizinische Dokumentation und Information, abgerufen am 9. November 2009.
- ↑ Kapitel XXII : Schlüsselnummern für besondere Zwecke (U00-U99) : Sonstige sekundäre Schlüsselnummern für besondere Zwecke (U69-U69). In: ICD-10-GM Version 2010. DIMDI Deutsches Institut für Medizinische Dokumentation und Information, abgerufen am 9. November 2009.
- ↑ Serum Cross-Reactive Antibody Response to a Novel Influenza A (H1N1) Virus after Vaccination with Seasonal Influenza Vaccine. In: Morbidity and Mortality Report Weekly. 22. Mai 2009
- ↑ a b WHO: Transcript of virtual press conference with Gregory Hartl, WHO Spokesperson for Global Alert and Response and Dr Marie-Paule Kieny, Director of the Initiative for Vaccine Research, World Health Organization 13 July 2009 (PDF, englisch)
- ↑ http://www.rki.de/cln_169/nn_196322/DE/Content/Infekt/EpidBull/Archiv/2009/50__09,templateId=raw,property=publicationFile.pdf/50_09.pdf RKI: Mitteilung der Ständigen Impfkommission (STIKO) am Robert Koch-Institut; Impfung gegen die Neue Influenza A (H1N1), Erneute Bewertung der Daten am 24.11.2009 - PDF-Datei
- ↑ Vaccines. European Medicines Agency, abgerufen am 10. November 2009 (englischsprachig): „Three vaccines that have benefited from these procedures, and which will thus be available for use in the current H1N1 influenza pandemic, are: * Focetria, which was recommended on 24 September 2009 by the European Medicines Agency for an EU-wide marketing authorisation. * Pandemrix, which was recommended on 24 September 2009 [...]. * Celvapan, which was recommended on 1 October 2009 [...].“
- ↑ a b c Authorisation procedures. European Medicines Agency, abgerufen am 20. November 2009 (englisch): „These procedures, managed by the European Medicines Agency, allow an influenza vaccine to be authorised more quickly than the 18 to 24 months usually required for the authorisation of a medicine in the EU.“
- ↑ a b c d Authorisation procedures : The mock-up authorisation procedure. European Medicines Agency, abgerufen am 20. November 2009 (englisch): „A mock-up vaccine is a type of flu vaccine that is developed well before a pandemic has started. Because the strain of flu virus that will cause a future pandemic is not known, pharmaceutical companies cannot start to prepare a vaccine containing the correct flu virus until a pandemic has started. To get around this problem, the mock-up procedure (also known as the ‘core dossier’ procedure) allows vaccine manufacturers to gain an authorisation for a prototype pandemic vaccine in advance of a pandemic. This approach is unique to pandemic vaccines.“
- ↑ a b Arzneimittelkommission der deutschen Ärzteschaft (Fachausschuss der Bundesärztekammer): Stellungnahme der Arzneimittelkommission der deutschen Ärzteschaft zur Schutzimpfung gegen die neue Influenza A (H1N1) vom 10. September 2009 (PDF, 10 S., „Diese Stellungnahme beruht auf dem Erkenntnisstand vom 09.09.2009.“), S. 5 („70 %“ und „Kreuzimmunität“)
- ↑ a b Erich Lederer: Grippeimpfung: Tanz ums Adjuvans online
- ↑ Kapitel Flu Vaccine im Artikel über das Unternehmen MedImmune in der englischsprachigen Wikipedia
- ↑ a b „Glaxo wins U.S. approval for swine flu vaccine“, Reuters, 10. November 2009
- ↑ a b c Impfung gegen Schweinegrippe: Alles im Griff (II): Fehleinschätzungen, Haftungsfreistellungen und viel Geld.. In: Arznei-Telegramm, 25. September 2009 (online)
- ↑ Frust in den USA: Zurzeit nicht genug Schweinegrippe-Impfdosen. In: Ärzte Zeitung, 23. Oktober 2009 (online)
- ↑ http://www.fda.gov/NewsEvents/PublicHealthFocus/ucm189691.htm
- ↑ a b c Statement des Paul-Ehrlich-Instituts zu Impfstoffen gegen die pandemische H1N1-Influenza (Schweinegrippe) : Gemeinsames Pressebriefing des Paul-Ehrlich-Instituts und des Robert Koch-Instituts am 06.08.09 in Berlin. Paul-Ehrlich-Institut, abgerufen am 12. November 2009.
- ↑ K. Johansen, A. Nicoll, B. C. Ciancio, P. Kramarz: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19361 Pandemic influenza A(H1N1) 2009 vaccines in the European Union. In: Eurosurveillance. 14, Nr. 41, 2009.
- ↑ Eva Richter-Kuhlmann, Nicola Siegmund-Schultze: Pandemieimpfstoffe: „Die Sicherheit ist gewährleistet“. In: Deutsches Ärzteblatt, 2009; 106(33): A-1610 (online)
- ↑ FAQs des Robert Koch-Instituts zur Impfung gegen saisonale und pandemische Influenza (online)
- ↑ Impfstoffe gegen die Schweinegrippe sind nach angemessenem Standard getestet. (online)
- ↑ Fragen und Antworten zu Impfstoffen gegen das pandemische (H1N1) 2009-Virus (Schweinegrippe). (online)
- ↑ Pandemieimpfstoffe: „Die Sicherheit ist gewährleistet“ Dtsch Arztebl 2009; 106(33): A-1610
- ↑ http://www.kinderaerzte-im-netz.de/bvkj/aktuelles1/show.php3?id=3368&nodeid=26
- ↑ Acht Antworten zur Schweinegrippe. Soll ich mich impfen lassen? In taz, 24. Oktober 2009 (online)
- ↑ Stellungnahme zu Risiken, die im Zusammenhang mit Squalen diskutiert werden: Squalen bzw. Squalen-Antikörper als angebliche Auslöser für das "Gulf war syndrome". Paul-Ehrlich-Institut, 12. November 2008, abgerufen am 12. November 2009.
- ↑ http://www.impfakademie.de/index.jsp?nodeid=10&cid=178
- ↑ Weitere Impfstoffe gegen die Schweinegrippe. In: Deutsches Ärzteblatt, 8. Oktober 2009 (online)
- ↑ Das Geschäft mit der Angst. In: Stern, 13. August 2009 (online)
- ↑ Die Seuche der Jungen. In: Der Spiegel, 9. November 2009 (online)
- ↑ Schweinegrippe: Schweden bereitet Massenimpfung vor. In: Ärzte Zeitung, 25. August 2009 (online)
- ↑ Zusammenfassung der Merkmale des Arzneimittels. In: Pandemrix : Latest preliminary information (Status: 22 October 2009). European Medicines Agency, S. 5-7, abgerufen am 9. November 2009 (PDF, deutschsprachig).
- ↑ Packungsbeilage. In: Pandemrix : Latest preliminary information (Status: 22 October 2009). European Medicines Agency, S. 4-5, abgerufen am 9. November 2009 (PDF, deutschsprachig).
- ↑ Medical Products Agency - Sweden: Summary of adverse drug reaction reports in Sweden with Pandemrix (online)
- ↑ Paul-Ehrlich-Institut: Erfahrungen mit der Impfung in Schweden
- ↑ a b Information zu Verdachtsfallberichten von Nebenwirkungen und Impfkomplikationen nach Anwendung des in Deutschland zugelassenen Schweinegrippe (H1N1)-Impfstoffs Pandemrix. Paul-Ehrlich-Institut, 9. November 2009, abgerufen am 11. November 2009.
- ↑ Ärzte Zeitung: Ärzte Zeitung erwartet noch andere beeinflussende Faktoren für das Auftreten der Narkolepsie-Fälle
- ↑ »Die Zeit«: Behörden prüfen einen Zusammenhang mit der Impfung
- ↑ Das Ärzteblatt: Arbeitsgruppe bezeichnet einen Zusammenhang zwischen Pandemrix und den Narkolepsie-Fällen als wahrscheinlich, vermutet aber auch bislang unbekannte Ko-Faktoren
- ↑ Übersicht Impfstoffe H1N1. In: Bundesamt für Gesundheit, 20. November 2009 ([1])
- ↑ Swissmedic erweitert Zulassung für Pandemrix. In: Aktuell > Mitteilungen. Swissmedic, Schweizerisches Heilmittelinstitut, 19. November 2009, abgerufen am 19. November 2009: „Ab sofort ist der Schweinegrippe-Impfstoff auch für über 60jährige zugelassen. Grundlage für diese Erweiterung der Zulassung waren klinische Daten, die eine Wirksamkeit des Impfstoffes in dieser Altergruppe belegten.“
- ↑ http://www.ema.europa.eu/pdfs/general/direct/pr/78440409en.pdf European Medicines Agency advises of risk of fever in young children following vaccination with Pandemrix EMEA Press release, London, 4 Dezember 2009 -PDF-Datie
- ↑ http://www.aerzteblatt.de/nachrichten/39223/H1N1-Impfung_bei_Kindern_Fieber_nach_zweiter_Pandemrix-Dosis.htm H1N1-Impfung bei Kindern: Fieber nach zweiter Pandemrix-Dosis aerzteblatt.de vom 4. Dezember 2009
- ↑ a b Packungsbeilage. In: Focetria : Latest preliminary information. European Medicines Agency, 22. Oktober 2009, S. 38-39, abgerufen am 11. November 2009 (PDF).
- ↑ Was ’Der Spiegel’ in seinem Artikel 'Immun gegen die Impfung' nicht geschrieben hat – Information des Paul-Ehrlich-Instituts vom 18. Oktober 2009
- ↑ Veronika Hackenbroch, Gerald Traufetter: Immun gegen die Impfung. In: Der Spiegel. Nr. 43, 2009, S. 140 (online).
- ↑ Celvapan: Keine Daten für Kinder und Schwangere. Berufsverband der Kinder- und Jugendärzte e. V. (BVKJ), Köln, 20. Oktober 2009, abgerufen am 12. November 2009.
- ↑ a b Packungsbeilage. In: Celvapan : Latest preliminary information (Status: 22 October 2009). European Medicines Agency, S. 4-5, abgerufen am 9. November 2009 (PDF, deutsch, Siehe hier auch zu nicht „häufigen“ Nebenwirkungen.).
- ↑ Packungsbeilage. In: Celvapan : Latest preliminary information (Status: 22 October 2009). European Medicines Agency, S. 5, abgerufen am 9. November 2009 (PDF, deutsch): „Aus laufenden klinischen Studien, in denen einer begrenzten Anzahl von Erwachsenen, älteren Personen und Kindern eine erste Dosis von Celvapan (H1N1) verabreicht wurde, wurden in den ersten Tagen nach der Impfung ähnliche Nebenwirkungen beobachtet, wie sie zuvor beim Celvapan (H5N1)-Impfstoff festgestellt wurden.“
- ↑ Pressemitteilung über Zulassung in Deutschland, 5. November 2009
- ↑ Swissmedic erteilt Zulassung für Celtura, 13. November 2009
- ↑ Fachinformation Celtura Fertigspritze
- ↑ a b Eva Richter-Kuhlmann, Marc Meißner, Nicola Sigmund-Schultze, Vera Zylka-Menhorn: Neue Influenza A/H1N1: Entscheidungshilfen für die Impfung. In: Deutsches Ärzteblatt Jg. 106 Heft 44. Bundesärztekammer und Kassenärztliche Bundesvereinigung, 30. Oktober 2009, S. A 2180-A 2182 (A 2182), archiviert vom Original, abgerufen am 13. November 2009 (PDF/HTML).>
- ↑ Autorisation de mise sur le marché du vaccin pandémique Panenza. Agence française de sécurité sanitaire des produits de santé (Afssaps), 16. November 2008, abgerufen am 17. November 2009 (französischsprachig, communiqué de presse): „L’agence vient d'accorder une autorisation de mise sur le marché (AMM) au vaccin Panenza dans la prévention de la grippe A (H1N1)v après avis favorable de la commission d’AMM rendu le 12 novembre 2009.“
- ↑ CSL Biotherapies GmbH (2009. Oktober 29): Gebrauchsinformation (PI/D/German) : CSL H1N1 Pandemic Influenza Vaccine (Split Virion, Inactivated) (PDF). Ministerium für Arbeit, Soziales, Gesundheit, Familie und Frauen des Landes Rheinland-Pfalz. Abgerufen am 11. Januar 2010.
- ↑ a b http://www.h1n1vax.com.au/s1/cs/auvx/1249870357676/content/1249870357436/content.htm Information auf der Herstellerseite
- ↑ a b http://secure.healthlinks.net.au/content/csl/cmi.cfm?product=cscpanva10909 Panvax(R) H1N1 Vaccine, Consumer Medicine Information
- ↑ http://www.dradio.de/dlf/sendungen/forschak/1068176/ Deutschlandfunk 11.11.2009, Forschung aktuell: Engpass bei Schweinegrippe-Impfstoff
- ↑ Heike Taubert: Heike Taubert (Vorsitzende der Gesundheitsministerkonferenz, Thüringen) über den zusätzlichen Impfstoff für Schwangere. 11. November 2009, abgerufen am 24. November 2009 (MP3, Audio-Datei, Link nicht im Originaltitel).
- ↑ Gebrauchsinformation online (englisch)

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- Impfstoff
- Arzneistoff
- ATC-J07
Wikimedia Foundation.