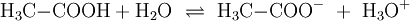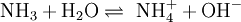- Bindungsdissoziationsenergie
-
Unter Dissoziation versteht man in der Chemie den angeregten oder den selbsttätig ablaufenden Vorgang der Zerlegung einer chemischen Verbindung in zwei oder mehrere Moleküle, Atome oder Ionen. Als Maß für die Dissoziation wird der Dissoziationsgrad oder die Dissoziationskonstante verwendet. Der Dissoziationsgrad gibt den Anteil der ursprünglichen Teilchen an, der dissoziiert ist. Dissoziationsenergie ist diejenige Energie, die notwendig ist, um eine chemische Bindung zu trennen.
Inhaltsverzeichnis
Elektrolytische Dissoziation
Die elektrolytische Dissoziation ist der reversible Zerfall einer Verbindung in Anionen und Kationen in einem Lösungsmittel. Solche Lösungen nennt man Elektrolyte. Eine solche Dissoziation findet beim Lösen von Salzen in Wasser statt. In diesem polaren Lösungsmittel liegt das Gelöste in Form von freibeweglichen Ionen vor. Diese freibeweglichen Anionen und Kationen führen zu einer elektrischen Leitfähigkeit des Wassers.
Bei den sogenannten echten oder permanenten Elektrolyten sind die Ionen bereits im Festkörper (→Ionengitter) vorhanden. So liegen bei festem Kochsalz bereits im Gitter Na+ und Cl--Ionen vor. Beim Auflösen des Salzes in Wasser bilden sich im Wasser nun freibewegliche Ionen. Bei der Dissoziation von Salzen in Ionen wird die recht hohe Gitterenergie des Kristalles durch Hydratationsenergie beim Lösungsvorgang aufgebraucht.
Bei den sogenannten potentiellen Elektrolyten liegen bei den Reinsubstanzen keine ionischen Bindungen vor. Als Reinsubstanz sind sie Nichtleiter. Beim Einbringen dieser Reinsubstanzen (AB) in ein Lösungsmittel erfolgt die Bildung von Ionen durch eine chemische Reaktion zwischen Gelöstem und Lösungsmittel:
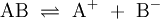 . Voraussetzung für eine solche Reaktion ist eine polare Bindung zwischen den Teilen A und B der Verbindung (AB) und ein polares Lösungsmittel. Wird beispielsweise reine Essigsäure in Wasser gegeben bilden sich als Kationen H3O + und die Anionen H3C − COO −
. Voraussetzung für eine solche Reaktion ist eine polare Bindung zwischen den Teilen A und B der Verbindung (AB) und ein polares Lösungsmittel. Wird beispielsweise reine Essigsäure in Wasser gegeben bilden sich als Kationen H3O + und die Anionen H3C − COO −Wird das Gas Chlorwasserstoff (HCl) in Wasser eingebracht, bildet sich eine elektrolytische Lösung, die Salzsäure genannt wird:
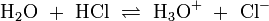 .
.
Wird das Gas Ammoniak (NH3) in Wasser eingebracht, bildet sich als Kationen
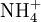 und die Anionen OH − :
und die Anionen OH − :Die Gleichgewichtsreaktionen dieser Beispiele nennt man auch Protolyse und wird dort genauer beschrieben. Dieses Verhalten macht Essigsäure und Salzsäure zu Säuren. Das Verhalten von Ammoniak macht Ammoniak zu einer Base. Die elektrische Leitfähigkeit dieser Lösungen ist der experimentelle Nachweis der Bildung von freibeweglichen Anionen und Kationen.
siehe auch:
Thermische Dissoziation
Bei der thermischen Dissoziation zerfallen Moleküle auf Grund der thermischen Eigenbewegung (Schwingungen, Rotationen etc.) in Bruchstücke. Thermische Dissoziation verlaufen in der Regel viel langsamer als elektrolytische Dissoziationen. Ein Beispiel für eine thermische Dissoziation bietet Distickstofftetroxid, das bei -10°C in Form von farblosen Kristallen vorliegt. Beim Erwärmen dissoziiert das Molekül in das intensiv braunrot gefärbte Stickstoffdioxid:
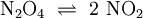 . Diese Reaktion ist reversibel. Beim Abkühlen entfärbt sich die Probe wegen der Rekombination zum Distickstofftetroxid wieder. Dissoziationen treten besonders bei Makromolekülen schon bei relativ niedrigen Temperaturen auf.
. Diese Reaktion ist reversibel. Beim Abkühlen entfärbt sich die Probe wegen der Rekombination zum Distickstofftetroxid wieder. Dissoziationen treten besonders bei Makromolekülen schon bei relativ niedrigen Temperaturen auf.Photochemische Dissoziation
Photochemische Reaktionen sind Reaktionen, die durch Absorption von UV-Strahlung, sichtbarer oder infraroter Strahlung ablaufen. Dabei können Addition, Substitution, Dissoziation und andere Reaktionen ablaufen. Interessant ist, dass Dissoziationsreaktionen auch an anderen Bindungsstellen als beispielsweise bei thermischer Dissoziation ablaufen. Sie bieten uns auch die Möglichkeit, direktes und reflektiertes Licht fotografisch festzuhalten. Durch Lichtquanten kann man auch Kettenreaktionen auslösen, die sich ausbreiten, weil sie selber Licht der entsprechenden Wellenlänge emittieren.
Bei der photochemischen Zersetzung zerfällt zum Beispiel ein Silberhalogenid in elementares Silber und einen Rest. Der Ionencharakter der meisten Silberhalogenidverbindungen ist nicht stark ausgeprägt, und es gibt Ionen, die im Gitter wandern können.
Die notwendige Energie für die Reaktion stammt von einem Lichtquant mit einer Wellenlänge <480 nm. Ein Elektron aus dem Valenzband wird durch die Absorption in das Leitungsband gehoben und wandert zu einem Silberion.
Ag+ + e- → Ag (fein verteilt, schwarz)
Homolytische Bindungsspaltung
Eine weitere, wichtige Art der Dissoziation ist die homolytische Spaltung einer kovaltenten Bindung bei der jeweils die Hälfte aller Bindungselektronen an die beiden Bindungspartner abgegeben werden. Siehe dazu Hauptartikel Homolytische Spaltung.
Siehe auch
Wikimedia Foundation.