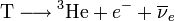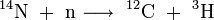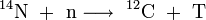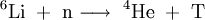- ³H
-
Strukturformel T–T Allgemeines Name Tritium Andere Namen - Überschwerer Wasserstoff
- Triplogen (veraltet)
Summenformel T2 (molekulare Form) CAS-Nummer 10028-17-8 PubChem 24824 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 6,032099 g·mol−1 Aggregatzustand gasförmig
Schmelzpunkt −252,5 °C
Siedepunkt −248,1 °C
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tritium (von griechisch τρίτος, trítos „der Dritte“) ist neben Protium und Deuterium ein natürliches Isotop des Wasserstoffs. Tritium wird aufgrund seiner Masse auch als „Überschwerer Wasserstoff“ bezeichnet. Sein Atomkern wird auch Triton genannt.
Eigenständige Namen für Isotope eines Elements gibt es nur bei Deuterium und Tritium, weil das Massenverhältnis zwischen Protium und seinen Isotopen verhältnismäßig groß ist (Deuterium 1:2 und Tritium 1:3) und sich daraus merkliche Unterschiede im chemischen Verhalten ergeben. (Zum Vergleich: Bei dem nächst größeren Isotopenpaar 3He und 4He sind es 1:1,33; bei 235U und 238U nur noch 1:1,013).
Inhaltsverzeichnis
Eigenschaften
 Wasserstoff, Deuterium, Tritium
Wasserstoff, Deuterium, TritiumDas chemische Symbol ist 3H; aus Gründen der Vereinfachung in der Formelschreibweise wird häufig auch T verwendet.
Im Gegensatz zum Deuterium besitzt es neben dem Proton nicht nur ein Neutron im Atomkern, sondern zwei. Dieser Atomkern ist aber instabil und zerfällt mit einer Halbwertszeit von 12,32 Jahren unter Emission eines Elektrons und eines Antineutrinos in 3He (Betazerfall):
Bei diesem Zerfall wird insgesamt eine Energie von 18,6 keV frei. Davon erhält das Elektron im Mittel 5,7 keV kinetische Energie,[2] Im Vergleich zu anderen Betastrahlern ist die Strahlung sehr weich. Sie wird in Wasser nach wenigen Mikrometern gestoppt und kann die oberen Hautschichten nicht durchdringen. Die Radioaktivität von Tritium ist daher vor allem bei der Ingestion oder beim Einatmen gefährlich.
Tritium entsteht auf natürliche Weise durch Neutronen-Beschuss auf Stickstoffkerne aus der kosmischen Strahlung in den oberen Schichten der Atmosphäre. Außerdem gelangt es mit dem Sonnenwind in die Erdatmosphäre.
oder auch
Tritium gelangt vor allem als HT (Tritiumwasserstoff) durch Konvektionsströmungen zur Erdoberfläche. Es gibt auf der Erde ca. 3,5 kg Tritium aus natürlicher Produktion[3], das sich zu 99 % in oberflächennahen Schichten der Ozeane befindet[4].
Tritium kann in Kernreaktoren durch Reaktion von 6Li mit Neutronen hergestellt werden:
Auf die gleiche Weise soll das zur Nutzung der Kernfusionsenergie benötige Tritium im Blanket von Kernfusionsreaktoren erbrütet werden.
In mit Schwerwasser moderierten Reaktoren (siehe z. B. CANDU) fällt Tritium in einer Menge von rund 1 kg pro 5 GWa erzeugter elektrischer Energie als unvermeidliches Nebenprodukt an und kann per Extraktion aus dem Kühlwasser gewonnen werden.
Tritiumoxid (überschweres Wasser) T2O hat eine Siedetemperatur von 101,51 °C und eine Schmelztemperatur von 4,48 °C.
Verwendung
Unter anderem in der Biologie, Chemie und Medizin wird Tritium als sog. Tracer zur Markierung bestimmter Substanzen verwendet.
Als Leuchtmittel wird gasförmiges Tritium zusammen mit einem Fluoreszenzmittel in versiegelten Borsilikatglasröhrchen verwendet. Die Betastrahlung des Tritiums regt die Beschichtung innen auf dem Glasröhrchen zu einem schwachen, fluoreszierenden Leuchten an. Diese »kalten Leuchten« haben eine theoretische Lebensdauer von mehreren Jahrzehnten und sind in verschiedenen Farben unter dem Handelsnamen Traser zu finden, siehe Tritiumgaslichtquelle.
Tritium wird auch als Leuchtmittel z. B. auf Uhrenzifferblättern und -zeigern verwendet.[5]
Auch Ionisationsrauchmelder arbeiten teilweise mit einer Tritiumgas-Ampulle als Ionisator.
Bei der Herstellung und Lagerung von größeren Mengen bestehen wegen der Radioaktivität allerdings gesundheitliche Risiken. Daher wird es durch phosphoreszierende Leuchtmittel, wie z. B. Superluminova ersetzt. In Rauchmeldern kann statt Tritium auch 241Am (Americium) verwendet werden.
Tritium ist ein entscheidender Bestandteil bestimmter Kernwaffen. Werden geringe Mengen von rund zwei bis drei Gramm gasförmigen Tritiums in die Waffe eingebracht, kann es die Sprengstoffwirkung von Kernspaltwaffen um den Faktor zwei bis zehn verstärken. Man spricht hier auch vom „boosting“. Für die Wasserstoff- oder Neutronenbombe ist Tritium sogar essentiell zur Funktion notwendig; hier werden jedoch größere Mengen von bis zu 20 Gramm Tritium pro Sprengkopf benötigt.[6]
In zukünftigen Fusionskraftwerken soll ein Gemisch aus Deuterium und Tritium als Brennstoff dienen.
Gegenwärtig wird der Einsatz von Tritium zur autarken Energieversorgung von Mikroprozessoren aus Silizium durch die Ausnutzung der beim Beta-Zerfall freiwerdenden Wärme diskutiert. An der Universität von Pittsburgh wurde im Jahr 2006 ein Verfahren entwickelt, durch Beschuss einer Quarzoberfläche mit einem energiereichen ultravioletten Laserstrahl Tritiumatome bis zu einer Tiefe von acht Mikrometern in die Quarzschicht einzubauen. Für die Anwendung des Verfahrens in Silizium muss diese Methode allerdings noch mit der in der Industrie zur Herstellung von Schaltkreisen eingesetzten Photolithographie kombiniert werden.
Sicherheitshinweise
Die von Tritium ausgehenden chemischen Gefahren sind zwar mit denen von Wasserstoff identisch, aber vergleichsweise zu vernachlässigen gegenüber den radioaktiven Gefahren als gasförmiger Betastrahler, die auch völlig andere Handhabungsvorschriften erfordern. Die Kennzeichnung für Wasserstoff gemäß Anhang I der Richtlinie 67/548/EWG würde hier eher verharmlosend wirken und wurde deshalb weggelassen.
Nachweis
Der Nachweis von Tritium erfolgt unter anderem mittels Flüssigszintillationszählern oder offenen Ionisationskammern.
Einzelnachweise
- ↑ Siehe "Sicherheitshinweise"
- ↑ Table of Nuclides beim Korea Atomic Energy Research Institute
- ↑ D. Lal und B. Peters: Cosmic ray produced radioactivity on the earth. Handbuch der Physik, Band 46/2, Seiten 551–612, Springer, Berlin, 1967.
- ↑ Jürgen Sültenfuß: Das Radionuklid Tritium im Ozean: Meßverfahren und Verteilung von Tritium im Südatlantik und im Weddellmeer, S. 3.
- ↑ www.oysterinfo.de - Homepage für Uhrenliebhaber mit ausführlichem Bericht über verschiedene Leuchtmassen (incl. Tritium).
- ↑ L. Colschen und M. B. Kalinowski: Tritium. Zeitschrift Wissenschaft & Frieden, Heft 4/91, BdWi-Verlag, 1991.
Siehe auch
Weblinks
- Betavoltaic (engl.), Strom aus Tritium
Wikimedia Foundation.