- Tetraphosphor
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Phosphor, P, 15 Serie Nichtmetalle Gruppe, Periode, Block 15, 3, p Aussehen weiß-beige (W)
dunkelrot (R)
Schwarz (S)CAS-Nummer 7723-14-0 Massenanteil an der Erdhülle 0,09 % Atomar Atommasse 30,97376 u Atomradius (berechnet) 100 (98) pm Kovalenter Radius 106 pm Van-der-Waals-Radius 180 pm Elektronenkonfiguration [Ne] 3s2 3p3 Elektronen pro Energieniveau 2, 8, 5 1. Ionisierungsenergie 1011,8 kJ/mol 2. Ionisierungsenergie 1907 kJ/mol 3. Ionisierungsenergie 2914,1 kJ/mol 4. Ionisierungsenergie 4963,6 kJ/mol 5. Ionisierungsenergie 6273,9 kJ/mol Physikalisch Aggregatzustand fest Modifikationen 6 Kristallstruktur monoklin Dichte W: 1,877 g/cm3
R: 2,340 g/cm3
S: 2,67 g/cm3Magnetismus unmagnetisch Schmelzpunkt 317,3 K (44,2 °C) Siedepunkt 550 K (277 °C) Molares Volumen 17,02 · 10−6 m3/mol Verdampfungswärme 12,129 kJ/mol Schmelzwärme 0,657 kJ/mol Dampfdruck 20,8 Pa bei 294 K Spezifische Wärmekapazität 769 J/(kg · K) bei 298 K Elektrische Leitfähigkeit W: 0 R: 0 S: 1,0 · 10−9 A/(V · m) Wärmeleitfähigkeit 0,235 W/(m · K) Chemisch Oxidationszustände ±3, 4, 5 Oxide (Basizität) P2O5 (leicht sauer) Normalpotential Elektronegativität 2,19 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 28P 270,3 ms ε 14,332 28 Si 29P 4,14 s ε 4,943 29 Si 30P 2,49 min ε 4,232 30Si 31P 100 %
Stabil 32P 14,26 d β− 1,711 32S 33P 25,34 d β− 0,249 33S 34P 12,43 s β− 5,374 34S 35P 47,3 s β− 3,989 35S NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [1] Roter Phosphor

Leicht-
entzündlich(F)
Weißer Phosphor



Leicht-
entzündlichSehr giftig Ätzend Umwelt-
gefährlich(F) (T+) (C) (N) R- und S-Sätze R: 11-16-52/53 (rot)
S: (2)-7-43-61 (rot)
weitere Sicherheitshinweise LD50 (oral, Ratte) Weißer Phosphor Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Phosphor (von griechisch φως-φορος phosphoros „lichttragend“, vom Leuchten des weißen Phosphors bei der Reaktion mit Sauerstoff) ist ein chemisches Element mit dem Symbol P und der Ordnungszahl 15.
Phosphor kommt in mehreren, sich untereinander stark unterscheidenden Modifikationen vor.
Phosphorverbindungen sind für alle Lebewesen essentiell und bei Aufbau und Funktion der Organismen in zentralen Bereichen beteiligt, wie der DNA und der zellulären Energieversorgung (ADP/ATP).
Inhaltsverzeichnis
Geschichte
Phosphor wurde 1669 von Hennig Brand, einem deutschen Apotheker und Alchemisten, entdeckt, als dieser – auf der Suche nach dem „Stein der Weisen“ – Urin bis zur Trocknung eindampfte. Als er den Rückstand unter Luftabschluss glühte, entstand durch Reduktion mit organischer Materie weißer Phosphor, der im Dunkeln aufgrund der Chemolumineszenz leuchtete. Obwohl Phosphor zu dieser Zeit noch keine Verwendung außer als Nachtlampe fand, wurde er mit Gold aufgewogen. Hennig Brand wurde durch diese Entdeckung nicht reich und verkaufte das Herstellungsrezept an einen Alchemisten, der damit ein Vermögen machte. Johann Daniel Kraft, besagter Alchimist, demonstrierte die Herstellung von Phosphor 1677 vor Robert Boyle. Bemerkenswert ist, dass Hennig Brand seinen Phosphorus in Hannover auch dem Wissenschaftler und Philosophen Wilhelm von Leibniz vorstellte, der aus Begeisterung über den geheimnisvollen Lichtträger ein Gedicht verfasste.
Weißer Phosphor wurde anfangs auf Grund seiner faszinierenden Eigenschaft − der Phosphoreszenz − als Heilmittel verwendet. Später erhielt er eine wichtige Bedeutung bei der Streichholzherstellung; da weißer Phosphor hochgiftig ist, kam es jedoch oft zu schweren Vergiftungen bei Arbeitern, die mit ihm in Berührung kamen.
Weißer Phosphor spielte in der Militärgeschichte als Waffe eine Rolle. Er wurde als Füllmaterial von Brandbomben, den sogenannten Phosphorbomben verwendet. So setzte die britische Luftwaffe im Zweiten Weltkrieg ein Gemisch aus weißem Phosphor und Kautschuk ein. Durch den Kautschuk klebt die zähflüssige Masse und lässt sich deshalb schlecht abstreifen. Sie verursacht auf der Haut schlecht heilende Wunden.
Vorkommen
In der Natur kommt Phosphor ausschließlich in gebundener Form, das heißt nicht gediegen, meist in Form der Phosphate in der Erdkruste vor (Gehalt in der Erdkruste: ~ 0,09 %>[6]). Typische Mineralien sind etwa die Apatite Ca5(PO4)3(F,Cl,OH). Besonders der Fluorapatit und der mit Calciumcarbonat durchsetzte Phosphorit stellen ökonomisch die wichtigsten Phosphate dar. Darüber hinaus gibt es weitere phosphorhaltige Mineralien, wie beispielsweise den Wavellit Al3(PO4)(F,OH) · 5 H2O, den Vivianit Fe3(PO4)2 · 8 H2O und den Türkis CuAl6[(PO4)(OH2)]4 · 4 H2O.
Die größten Vorkommen an Phosphat-Mineralien findet man in Afrika (Marokko, Westsahara), in China und den USA (Florida). Die kontinentalen Vorkommen reichen nur noch für wenige Jahrzehnte; Schätzungen variieren zwischen 50[7] und 130 Jahren.[8] Es existieren allerdings große Vorkommen unter Wasser, die momentan nicht ökonomisch abgebaut werden können.[9]
Außer in Mineralien kommt Phosphor auch in Ablagerungen von Vogelkot von Meeresvögeln, dem sogenannten Guano (enthält 7–8 %, selten bis 60 % Chilesalpeter und maximal etwa 40 % Phosphate)[10] vor. Dieser findet sich vorwiegend auf einigen Inseln im Pazifischen Ozean, wie Nauru oder Kiribati und in Südamerika (Peru/Chile). Auf Nauru gehen die Phosphor-Vorräte seit Mitte der 1970er Jahre kontinuierlich zurück und sind mittlerweile fast völlig erschöpft.
Von den weltweit jährlich geförderten etwa 100 Millionen Tonnen an Rohphosphaten werden etwa 90 % zur Herstellung von Düngemitteln verwendet. Phosphor kann in Düngemitteln durch keinen anderen Stoff ersetzt werden[11].
Phosphor hat auch in der organischen Welt eine wichtige Bedeutung und kommt in verschiedensten Bereichen der Fauna und Flora vor: Etwa als Hydroxylapatit Ca5(PO4)3OH, der einer der Hauptbestandteile der Gerüstsubstanz ist, die in Knochen und Zähnen vorkommt. Weiterhin spielen Phosphorverbindungen als Bestandteile der Nukleinsäuren und als Bestandteil des Energieträgers ATP eine wichtige Rolle in lebenden Organismen.
Gewinnung und Darstellung
Dazu wird in elektrischen Lichtbogenöfen Calciumphosphat in Form der Mineralien Phosphorit oder Apatit mit Koks und Quarzsand auf 1400 °C erhitzt und so zu weißem Phosphor umgesetzt. Der im Koks enthaltene Kohlenstoff wirkt dabei als Reduktionsmittel und das Siliciumdioxid des Quarzes dient als Schlackenbildner. Der beim Prozess gasförmig anfallende Phosphor wird kondensiert und unter Wasser gesammelt.
Modifikationen und Eigenschaften
Phosphor tritt in vier allotropen Modifikationen als weißer, roter, schwarzer und violetter Phosphor auf. Jeder dieser Grundtypen bildet verschiedene Kristallstrukturen. Dadurch kommt es zu sehr großen Unterschieden in physikalischen Eigenschaften und Reaktivität.
Da die anderen Modifikationen schwer direkt zu gewinnen sind, wird zunächst immer weißer Phosphor produziert und dieser dann in andere Modifikationen umgewandelt. Diese können durch hohen Druck und hohe Temperatur ineinander überführt werden. Der schwarze Phosphor ist bei Raumtemperatur die eigentlich stabile Modifikation, die anderen sind allerdings auf Grund der geringen Umwandlungsgeschwindigkeit metastabil. Weißen Phosphor kann man im Labor durch Erhitzung von Rotem Phosphor unter Ausschluss von Sauerstoff herstellen. Umgekehrt kann roter Phosphor auch durch mehrstündiges Erhitzen von weißem Phosphor auf etwa 360 °C erzeugt werden.
Gasförmiger Zustand
Im Phosphordampf überwiegen unterhalb von 1200 °C P4-Tetraeder als kleinste molekulare Einheiten. Der Dissoziationsgrad beträgt bei 800 °C ~ 1 %. Zwischen 1200 und 2000 °C überwiegen P2-Moleküle mit stickstoffanaloger Valenzelektronenstruktur, oberhalb von 2000 °C dissoziieren diese mit steigenden Temperaturen schließlich langsam zu atomarem Phosphor.
Weißer Phosphor
Weißer Phosphor ist die flüchtigste und reaktivste Modifikation des Phosphors. Er besitzt eine Dichte von 1,82 g/cm3, einen Schmelzpunkt von 44,25 °C, einen Siedepunkt von 280,5 °C und ist durchscheinend und wachsartig. Verunreinigt wird der weiße Phosphor auch als gelber Phosphor bezeichnet. Der kubische weiße Phosphor ist in Phosphortrichlorid und Kohlenstoffdisulfid CS2 sehr leicht löslich; 100 g Kohlenstoffdisulfid lösen mehr als 1 kg Phosphor. In Tetrachlorkohlenstoff, Benzol oder Ether ist Phosphor schwach löslich. Da er in Wasser schlecht löslich ist, wird weißer Phosphor unter Wasser aufbewahrt.
Bei –76,9 °C geht die kubische Form (α-Form) in eine hexagonale Form (β-Form) über (Rotation der freien Außenelektronen "eingefroren"). In jeder Form (α-, β-, in Lösung) bildet weißer Phosphor P4-Tetraeder mit einem Bindungswinkel von 60°.
In fein verteiltem Zustand entzündet sich weißer Phosphor an der Luft von selbst, ab etwa 50 °C entzünden sich auch kompakte Stücke und verbrennen zu Phosphor(V)-oxid. Daher muss weißer Phosphor unter Wasser aufbewahrt werden. Brennender Phosphor darf nicht mit Wasser gelöscht werden, da die Gefahr besteht, dass der Phosphorstaub in feine Ritzen gespült wird und sich nach Verdunstung des Wassers wieder selbst entzündet. Brennender Phosphor wird am besten mit Sand gelöscht.
An der Luft kann weißer Phosphor eine hellgrüne Chemolumineszenz zeigen. Diese entsteht aus dem durch den hohen Dampfdruck des weißen Phosphors in der Umgebung vorhandenen gasförmigen P4, das durch Gasphasenoxidation über P4O6 zu P4O10 reagiert. Meist in heftiger exothermer Reaktion verbindet sich Phosphor mit Halogenen, Metallen oder Schwefel. Die hieraus entstehenden Verbindungen sind Phosphorsulfide, Phosphor(III)- oder Phosphor(V)-Verbindungen sowie Phosphide. Unter Einwirkung von starken Laugen bei hoher Temperatur disproportioniert Phosphor zu Phosphan und Hypophosphit. Bedingt durch die hohe Affinität von Phosphor zu Sauerstoff, die durch die starke Phosphor-Sauerstoff-Bindung bewirkt wird, wirkt weißer Phosphor stark reduzierend. So wird Schwefelsäure beim Erwärmen mit weißem Phosphor zu Schwefeldioxid reduziert.
Das bei der Verbrennung von Phosphor entstehende Phosphorpentoxid ist stark hygroskopisch und bildet mit der Luftfeuchtigkeit dichte Nebel aus Phosphorsäure. Weißer Phosphor wird deshalb in Nebelgranaten verwendet.
Toxizität
Weißer Phosphor ist hochgiftig, schon 50 mg sind für den Menschen tödlich. Der Tod tritt erst nach fünf bis zehn Tagen ein. Auch wird weißer Phosphor nur langsam ausgeschieden.
Die Toxizität des weißen Phosphors wird vor allem auf sein hohes Reduktionsvermögen zurückgeführt, wodurch intrazelluläre oxidative Stoffwechselabläufe wie Eiweiß- und Kohlenhydratsynthese gestört werden. Dies betrifft vorwiegend enzymatisch gesteuerte Stoffwechselvorgänge in der Leber. Eine weitere Gefahr bilden die durch Reaktion mit Wasser gebildeten hochgiftigen Phosphane, die als starke Stoffwechselgifte eine besondere Affinität zum Zentralnervensystem besitzen.[12]
Schwarzer Phosphor
Die bei Zimmertemperatur stabilste Modifikation existiert in einer amorphen und drei kristallinen Formen. Schwarzer Phosphor ist aufgrund seiner polymeren Form unlöslich, deutlich schwerer entflammbar, sehr reaktionsträge und besitzt eine Dichte von 2,69 g/cm3. Daher ist der schwarze Phosphor ebenso wie der rote Phosphor ungiftig. Das dem schwarzen Phosphor zugrundeliegende Kristallgitter besteht aus gewellten Doppelschichten, in dem die Phosphoratome pyramidal mit drei weiteren in der Nachbarschaft befindlichen Phosphoratomen in einem Bindungswinkel von 100° verbunden sind. In dieser Konfiguration besitzt Phosphor Halbleitereigenschaften. In feuchter Luft oxidiert schwarzer Phosphor etwas schneller als roter Phosphor, überzieht sich dabei aber mit einer farblosen, viskosen Flüssigkeitshaut aus Phosphorsäuren, so dass der weitere Sauerstoffzutritt verhindert und eine Entzündung erschwert wird. Der normale schwarze Phosphor kristallisiert orthorhombisch, bei 80000 Bar wandelt sich dieser reversibel in eine rhomboedrische und bei 110000 Bar in eine kubische metallische Modifikation.
Schwarzer Phosphor entsteht unter hohem Druck aus weißem oder rotem Phosphor und unterscheidet sich durch seine Farbe stark von den vorgenannten. Es sieht grau-schwarz, glänzend und faserig wie Holz aus. Neuerdings wurde auch eine Niederdruckmodifikation hergestellt.[13][14]
Roter Phosphor
Eine Reihe amorpher und kristalliner Formen mit Dichtevariationen zwischen 2,0 und 2,4 g/cm3 und Schmelzpunkten zwischen 585 °C und 610 °C werden unter der Bezeichnung roter Phosphor zusammengefasst. Gemeinhin ist roter Phosphor amorph, lässt sich aber durch Rekristallisation aus geschmolzenem Blei in den monoklinen Hittorfschen (violetten) Phosphor überführen, welcher eine dreidimensional vernetzte polymere Form bildet.
Gewonnen wird roter Phosphor durch mehrstündiges Erhitzen von weißem Phosphor auf etwa 260 °C unter Luftabschluss. Eine langsame Umwandlung geschieht auch bei Lichteinwirkung. Iod katalysiert die Umwandlung von weißen in roten Phosphor.[14]
Die Unterschiede zwischen den kristallinen Anteilen im roten Phosphor bedingen die verschiedenen Formen desselben. Einfluss haben hier die Korngröße, die Art des Gitters, Verunreinigungen und die verschiedenen Absättigungen der Randgruppen mit Halogenen, Sauerstoff und Hydroxylgruppen.
Roter Phosphor ist zwar nicht selbstentzündlich, kann aber mit starken Oxidationsmitteln durch geringe Energiezufuhr (Reibung, Schlag) zur schlagartigen Entzündung oder gar zur Explosion gebracht werden. Bezogen auf die Reaktivität gleicht der violette Phosphor eher dem schwarzen Phosphor, während sich der Schencksche Phosphor sehr viel reaktionsfreudiger zeigt als „normaler“ roter Phosphor.
Roter Phosphor ist, im Gegensatz zu weißem Phosphor, nicht giftig. Seine Erstbeschreibung wird Anton Schrötter von Kristelli zugeschrieben.
Hellroter Phosphor
Der Hellrote oder auch Schencksche Phosphor (Rudolf Schenck, 1902) entsteht durch Kochen von weißem Phosphor in Phosphortribromid (PBr3). Das Produkt ist eine Mischverbindung aus Phosphor mit 10 bis 30 % Brom, deren Dichte bei 1,88 g/cm3 liegt.[14]
Violetter/Hittorfscher Phosphor
Violetter Phosphor entsteht beim ein- bis zweiwöchigen Erhitzen von weißem Phosphor auf ca. 550 °C.[14] Entdeckt wurde er von Johann Wilhelm Hittorf. Es handelt sich um ein nichtleitendes Polymer, das unlöslich in CS2 ist. Die Strukturaufklärung gelang Ende der 1960er Jahre an der Universität Stuttgart durch Herbert Thurn. Auch der violette Phosphor ist ungiftig.
Phosphor-Nanostäbchen
Im August 2004 ist es deutschen Forschern gelungen, zwei weitere Modifikationen des vielgesichtigen Elements zu isolieren und strukturell zu charakterisieren: Phosphor-Nanostäbchen. Bei diesen beiden Modifikationen liegen die Phosphoratome in Form von Kettenmolekülen (Polymeren) vor. Entdecker der neuen Modifikationen sind Arno Pfitzner von der Universität Regensburg und Hellmut Eckert von der Westfälischen Wilhelms-Universität in Münster.[15] Die rotbraunen Fasern, die sich deutlich von der roten Phosphormodifikation unterscheiden, sind an der Luft in trockenem Zustand über Wochen stabil. Unter dem Elektronenmikroskop zeigte sich diese rotbraune Phosphor-Form als lange, parallel ausgerichtete Nanostäbe mit Querschnitten von ungefähr 0,34 nm (Nanometer) beziehungsweise 0,47 nm.
Isotope
Phosphor hat nur ein stabiles Isotop: 31P, dies ist das einzige in der Natur vorkommende Isotop des Phosphors. Er ist somit anisotop. Phosphor hat mehrere weitere Isotope, die allerdings alle radioaktiv sind. Das Phosphorisotop 33P hat mit 25,3 Tagen die längste Halbwertszeit. Das Phosphorisotop 32P, welches auch radioaktiv ist, wird in Medizin und Forschung als Tracer benutzt, um Stoffwechselprozesse zu beobachten. Es wird beispielsweise beim 32P-Postlabeling genutzt.
Verwendung
Der größte Teil (80 %) des hergestellten weißen Phosphors wird zu Phosphor(V)-oxid verbrannt, das als Ausgangsmaterial für die Phosphorsäureherstellung sowie für die Darstellung verschiedener Phosphate verwendet wird. Phosphor(V)-oxid hat außerdem noch Bedeutung als eine der wirksamsten wasserentziehenden Substanzen (Trockenmittel).
Ein weiterer Teil wird zu Phosphortrichlorid (PCl3) und Phosphor(V)-sulfid (P4S10) verarbeitet, die wiederum als Grundstoffe für die Herstellung von Flammschutzmitteln, Additiven, Weichmachern und Pflanzenschutzmitteln dienen.
Roter Phosphor findet Verwendung bei der Streichholzherstellung. Paradoxerweise wird roter Phosphor in fein verteilter Form auch Kunststoffen (z. B. Polyamid) als Flammschutzmittel zugesetzt: Die Reaktionsprodukte von Phosphor, Luftsauerstoff und Wasser (Luftfeuchte, Restfeuchte im Kunststoff) bilden dabei eine verkohlte Schutzschicht gegen die Flammen. Außerdem fungieren gebildete Phosphorsuboxide, z.B. PO, als Radikalfänger und unterbrechen auf diese Weise die Verbrennung in der Gasphase[16].
Des Weiteren werden die als Dünger wichtigen Phosphate direkt aus Calciumphosphat gewonnen, indem dieses mit Schwefelsäure aufgeschlossen wird. Es entsteht das so genannte Superphosphat. Hierzu werden etwa 60 % der weltweiten Schwefelsäureerzeugung benötigt.
Roter und weißer Phosphor werden auch für militärische Zwecke genutzt. Der sehr giftige und selbstentzündliche weiße Phosphor wird in Brandmunition wie etwa Phosphorbomben verwendet und wurde früher auch in Nebelmunition eingesetzt. In moderner Nebelmunition wird jedoch der ungiftige rote Phosphor in Mischungen mit Oxidationsmitteln und metallischen Brennstoffen verwendet[17] .
Bis in die 1980er Jahre wurde mit weißem Phosphor auch in Schulen experimentiert, was aus gesundheitlichen Gründen verboten wurde. Nun darf nur noch roter Phosphor in Experimenten eingesetzt werden.
Im Boden
Auf natürlichem Wege gelangt Phosphor einerseits über die Apatit-Verwitterung in den Boden oder aber aus zersetzter organischer Materie. Die atmosphärische Deposition spielt bei Phosphor nur eine untergeordnete Rolle. Durch Düngung erhöht der Mensch aktiv den Phosphorgehalt im Boden meist über Phosphate. Als Hauptfaktoren der Verluste kann die Erosion betrachtet werden. Die Auswaschung ist sehr gering und abgesehen von Phosphan-Gas kommt es zu keiner Ausgasung aus dem Boden. Phosphor besitzt eine sehr schlechte Löslichkeit. So führt zum Beispiel eine Adsorption an Fe- und Al-Hydroxide in sauren Böden zu einer Phosphatfixierung. In basischen Böden kommt es zu einer Ausfällung mit Calcium. Generell kann man zwischen drei unterschiedlichen Phosphatfraktionen im Boden unterscheiden:
- In der Bodenlösung verfügbares Phosphat ist direkt pflanzenverfügbar. Jedoch ist diese mit 1–2 kg/ha die kleinste Fraktion.
- Labiles Phosphat ist durch spezifische Sorption an Eisen- und Aluminium-Oxide oder an Tonminerale locker gebunden. 450–900 kg/ha können so im Boden vorliegen. Durch Resorption kann aus dieser Fraktion pflanzenverfügbares Phosphat gebildet werden.
- Stabiles Phosphat hat praktisch keine Bedeutung für die Pflanzenernährung, obwohl es mit 3000–6000 kg/ha die größte der drei Fraktionen ist. Als wichtigste Vertreter seien hier Apatite und Calciumphosphate genannt.
Biologische Bedeutung
Physiologie
Phosphor ist für alle biologischen Organismen essentiell. Phosphorverbindungen sind Bestandteil der DNA- und RNA-Moleküle, der Trägersubstanz der Erbinformationen aller Lebewesen. Die stark phosphorhaltige Verbindung Adenosintriphosphat spielt eine entscheidende Rolle beim Energiestoffwechsel (aktivierte Zucker) der Zellen. Phosphor ist weiterhin in Zuckerphosphaten, Phospholipiden und Coenzymen enthalten. Die Phosphorylierung ist einer der wichtigsten Regulationsmechanismen in Organismen. Phosphate sind auch ein elementarer Bestandteil des pH-Puffersystems im Blut.
Die Trockenmasse von terrestrischen Pflanzen enthält ca. 0,2 % Phosphor[18], die von Säugetieren wie Menschen ca. 4 %. Die Gerüstsubstanz von Knochen und Zähnen besteht hauptsächlich aus Hydroxylapatit (Ca5(PO4)3OH). Der Körper eines Menschen von 70 kg Gewicht enthält etwa 700 Gramm Phosphor, wovon 600 g fest im Knochensystem gebunden sind.
Der Tagesbedarf eines erwachsenen Menschen beträgt ca. 0,75 Gramm Phosphor, vor allem in Milchprodukten, Fleisch, Fisch und Brot ist er reichhaltig vorhanden. Die Phosphatverfügbarkeit wirkt für Pflanzen vielfach als limitierender Wachstumsfaktor, weswegen in der Landwirtschaft große Mengen phosphathaltigen Düngers ausgebracht werden müssen.[19]
Weißer Phosphor und einige Phosphorverbindungen wie Phosphan sind sehr giftig.
Ökologie
Phosphor ist wegen seiner unverzichtbaren physiologischen Rolle einer der wichtigsten Pflanzennährstoffe. Allerdings neigen die in der Natur hauptsächlichen Phosphorvorkommen, die Phosphate, zur Bildung schwer löslicher und damit schwer verfügbarer Verbindungen. Trotz seines vergleichsweise geringen Bedarfsmengenanteils gerät Phosphor deshalb meist in die Rolle des „Limitierenden Faktors“ entsprechend Liebigs Minimumgesetz.
Die Landwirtschaft reagiert auf diese Tatsache mit dem Ausbringen von phosphathaltigen Düngemitteln, um den Pflanzenertrag zu steigern.
In den Gewässern hängt die Produktion von Biomasse meist direkt mit der verfügbaren Menge an Phosphor zusammen. Steigerungen des Phosphoreintrags in Seen führen deshalb zur Eutrophierung. Ganz allgemein beurteilt man den Zustand von Seen nach ihrem „Nährstoffgehalt“ und dessen Folgen für das Wachstum von Algen, und meint damit praktisch immer den verfügbaren Phosphorgehalt. Auch in den Flüssen spielt Phosphor eine wichtige eutrophierende Rolle. Deshalb wird heute in Kläranlagen Phosphor durch verschiedene Verfahren entfernt (Phosphorelimination), wobei die Rückgewinnung von Phosphor bzw. von Phosphaten - wegen der Endlichkeit der natürlichen Vorkommen - eine immer größere Bedeutung erlangt.
Wegen der ökologisch zentralen Bedeutung des Phosphats spielt auch die quantitative Phosphoranalytik eine wichtige Rolle in der Praxis der chemischen Gewässer- und Bodenüberwachung.
Nachweis
Spektroskopisch
Die Methode der Wahl für den Nachweis von Phosphorverbindungen ist die 31P-NMR-Spektroskopie. 31P ist das einzige natürlich vorkommende Phosphor-Isotop und hat eine Kernspin-Quantenzahl von 1/2. Im Vergleich zum Wasserstoff beträgt die relative Empfindlichkeit nur 6,6 %. Der Resonanzbereich beträgt ca. 700 ppm (P4 hat beispielsweise eine Verschiebung von −488 ppm). Als Standard wird im Allgemeinen 85%ige Phosphorsäure verwendet. Da Phosphor ein Spin-1/2-Kern ist, sind die Spektren sehr gut auszuwerten. Wenn zusätzlich der Wasserstoff entkoppelt wird, resultiert meist ein scharfes Signal. Die Phosphorverschiebung ist stark abhängig von seinen Bindungspartner, er ist also sehr gut für die Identifikation von bekannten Verbindungen geeignet. Bei unbekannten Verbindungen ist die Aussagekraft oft beschränkt, weil einem Spektrenbereich nur selten einer Verbindungsklasse exklusiv zuzuordnen ist.
Eine grobe Einteilung Derivate mit Chemische Verschiebung (δ in ppm) 3-bindigem P −180 bis +200 4-bindigem P −120 bis +130 5-bindigem P −100 bis −20 6-bindigem P −220 bis −130 Nasschemisch
Die quantitative und qualitative Bestimmung von Phosphor erfolgt über das Phosphat (genauer Orthophosphat PO43−). Gebundener Phosphor wird hierzu gegebenenfalls durch oxidierenden Aufschluss in Phosphat überführt.
Qualitativer Nachweis
Bei der Nachweisreaktion mit Ammoniummolybdat erhält man in saurer Lösung einen gelben Niederschlag von Ammoniummolybdophosphat:
In alkalischer Ammoniaklösung fällt Phosphat bei Anwesenheit von Magnesium-Ionen als Magnesiumammoniumphosphat aus:
Der Nachweis ist auch in Form von Zirconiumhydrogenphosphat durchführbar:
Nicht korrekt ist, wie in vielen Lehrbüchern angegeben, die Form Zr3(PO4)4, in wässrigen Lösungen bildet sich diese Verbindung nicht!
Historisch ist die Mitscherlich-Probe zum Nachweis von weißem Phosphor interessant, die allem voran bei vermuteten Phosphorvergiftungen eingesetzt wurde. Hierbei wird der Mageninhalt mit Wasser erhitzt, wobei der weiße Phosphor, der mit dem Wasserdampf flüchtig ist, anschließend kondensiert und bei Berührung mit Luftsauerstoff durch ein Leuchten (Chemolumineszenz) in Erscheinung tritt.
Bei Strukturuntersuchungen von Verbindungen, in denen Phosphor enthalten ist, eignet sich die 31P-Kernresonanzspektroskopie.
Quantitativer Nachweis
Gravimetrie
Für eine gravimetrische Bestimmung kann aus Phosphat und Molybdationen in stark salzsaurer Lösung ein gelbes Molybdophosphation gebildet werden:
Mit 8-Hydroxychinolin (kurz HOx oder Oxin genannt) bildet sich ein schwer löslicher Niederschlag von Oxin-12-molybdo-1-phosphat, der anschließend bei 160 °C getrocknet und in wasserfreier Form gewogen wird.
- Fällungsform:
- Wägeform:
- (H2Ox)3[P(Mo3O10)4] (Farbe: dunkelorange)
Der grobkristalline Niederschlag enthält nur 1,37 % Phosphor. Somit sind vor allem kleinere Phosphatmengen gut bestimmbar (siehe Mikromol-Verfahren).
Volumetrie
Volumetrische Phosphatbestimmungen werden durch Fällung mit La3+ oder mit Bi3+-Maßlösungen und anschließender Rücktitration mit EDTA durchgeführt.
Colorimetrie/Photometrie
Für die Bestimmung geringer Konzentrationen an Phosphat in Süßwasserproben wird ein tiefblauer Antimon-Phosphormolybdat-Komplex gebildet, der seine intensive Färbung erst durch ein Reduktionsmittel, meist Ascorbinsäure, erhält. Damit sind empfindliche Nachweise bis in den Bereich von ca. 0,6 mg PO4/l (ca. 0,2 mg P/l) möglich. Das Verfahren ist in DIN EN ISO 6878 (früher EN 1189:1996 bzw. DIN 38405 D11) normiert.
Sicherheitshinweise
Weißer Phosphor
Weißer Phosphor kann sich an der Luft entzünden, wenn er fein verteilt vorliegt. Die Selbstentzündungstemperatur liegt bei rund 34 °C, also sehr nahe bei Raumtemperatur. Die Reaktion zu Phosphorpentoxid ist stark exotherm. Mit Wasser und Alkalihydroxiden können giftige Phosphane entstehen. Starke Oxidationsmittel reagieren meist explosionsartig.
Die Entsorgung phosphorhaltiger Munition nach dem Zweiten Weltkrieg in flachen Ostseeabschnitten führt immer wieder zu schweren Verletzungen und Todesfällen. Die bernsteinfarbenen Phosphorklumpen werden angespült und gefährden damit vor allem Fischer oder Touristen. Statistiken zu Folge starben nach dem Zweiten Weltkrieg 168 Menschen durch Munitionsreste in der Ostsee, 250 Menschen wurden zum Teil schwer verletzt.[20][21]
Akute Vergiftungen äußern sich durch gastrointestinale Störungen, Leberschädigung mit schweren Stoffwechselstörungen sowie Schädigung von Herz und Nieren. Chronische Vergiftungen führen auch in geringen Mengen zu Störung des Allgemeinbefindens und Schädigung von Blut und der Knochen (Osteoporose), besonders am Kiefer.
Dosen ab 15 mg weißem Phosphor können schwere toxische Wirkungen auslösen. Mengen ab 50 mg (~1 mg/kg Körpergewicht) können bereits letal wirken.[22]
Andere Modifikationen
Die anderen bekannten Modifikationen von Phosphor sind wegen ihrer Wasserunlöslichkeit und geringeren Reaktivität in reiner Form ungiftig. Auch entzünden sie sich erst bei höherer Temperatur (Roter Phosphor erst bei 260 °C).
Verbindungen
Phosphor ist sehr reaktiv und bildet mit sehr vielen Nichtmetallen kovalente Verbindungen. Dabei kommt er in allen Oxidationsstufen zwischen –3 und +5 und den Koordinationszahlen 1 bis 6, meist 3 bis 4, vor. Die Oxidationszahlen –3 und +5 sind dabei bevorzugt.
Wasserstoffverbindungen
Phosphane (die alten Bezeichnung Phosphine ist nicht mehr IUPAC-konform, wird aber in der chemischen Literatur, v. a. in der angelsächsischen, fast ausschließlich verwendet) bezeichnen Verbindungen des dreibindigen Phosphors mit Wasserstoff oder Ersatz einer oder mehrere Wasserstoffatome durch organischen Gruppen als Bindungspartner. Die organische Gruppe muss über die Kohlenstoffatome des Grundgerüstes direkt mit dem Phosphoratom verbunden sein. Wird die organische Gruppe durch ein Sauerstoffatom an das Phosphoratom gebunden (also Einheit P-O-C, z. B. im P(OPh)3), spricht man von Phosphiten.
Sauerstoffverbindungen
Mit Sauerstoff bildet Phosphor verschiedene Verbindungen, da Phosphor in mehreren Oxidationsstufen vorliegen kann. Dabei sind sowohl Phosphor-Sauerstoff-Einfachbindungen als auch Doppelbindungen sowie verbrückende Phosphor-Sauerstoff-Phosphor-Bindungen möglich.
Phosphoroxide bilden dem Adamantan ähnliche Strukturen:
- Phosphortrioxid P4O6 ist eine weiße, weiche Verbindung, die sehr giftig und reaktiv ist und schnell zu Phosphorpentoxid weiterreagiert.
- Phosphortetraoxid P2O4 ist ein Mischoxid. Man kann es durch Oxidation von Phosphortrioxid in Tetrachlorkohlenstoff gewinnen.
- Phosphorpentoxid P4O10 ist das wichtigste Phosphoroxid. Es ist sehr hygroskopisch und wird als Trocknungsmittel verwendet.
Von diesen Oxiden können eine große Zahl von Phosphor-Sauerstoff-Säuren und ihre entsprechenden Salze mit einem oder mehreren Phosphoratomen abgeleitet werden:
Oxidationsstufe
des PhosphorsStrukturformel Name der Säure Name der Salze Monophosphorsäuren +I Phosphinsäure Phosphinate +III Phosphonsäure Phosphonate +V Phosphorsäure Phosphate +V Peroxophosphorsäure Peroxophosphate Diphosphorsäuren +II Hypodiphosphonsäure Hypodiphosphonate +III Diphosphonsäure Diphosphonate +IV Hypodiphosphorsäure Hypodiphosphate +V Diphosphorsäure Diphosphate +V Peroxodiphosphorsäure Peroxodiphosphate Es existieren auch schwefelhaltige Derivate dieser Säuren, z.B. die Thiophosphorsäure, deren Salze Thiophosphate heißen.
Es gibt außerdem eine Reihe von phosphorhaltigen Mineralien, die wichtigsten darunter sind Hydroxylapatit und Fluorapatit. Weitere Phosphormineralien findet man in der Kategorie:Phosphormineral.
Halogenverbindungen
Phosphor bildet eine große Zahl von Verbindungen mit den Halogeniden Fluor, Chlor, Brom und Iod. Die wichtigsten Verbindungentypen sind dabei PX3, P2X4 und PX5. Die Fluorverbindungen sind gasförmig, die Chlorverbindungen meist flüssig, Brom- und Iodverbindungen fest. Viele Phosphorhalogenverbindungen sind giftig. Beispiele für diese Verbindungsklasse sind Phosphortrichlorid und Phosphorpentachlorid.
Weitere Phosphorverbindungen
Phosphor bildet mit Schwefel eine Reihe von Verbindungen, die in ihrer Struktur z. T. den Phosphor-Sauerstoff-Verbindungen ähneln. Sie haben allgemein die Struktur P4Sx (x = 3–10). Auch Verbindungen mit Selen sind bekannt.
Stickstoff bildet mit Phosphor Nitride der Zusammensetzung PN und P3N5.
Organische Verbindungen
Organische Phosphorverbindungen − dabei vor allem Triphenylphosphin − spielen in vielen organischen Reaktionen, z. B. der Wittig-Reaktion eine wichtige Rolle.
In der Biochemie sind vor allem die Phosphorsäureester relevant. Sie sind lebenswichtiger Teil von vielen Stoffwechselprozessen und Teil der DNA. Wichtige Moleküle sind:
Einzelnachweise
- ↑ Eintrag zu CAS-Nr. 7723-14-0 im European chemical Substances Information System ESIS
- ↑ a b National Technical Information Service. Vol. AD-B011-150
- ↑ Pesticide Chemicals Official Compendium, Association of the American Pesticide Control Officials, Inc., 1966. Vol. -, Pg. 901.
- ↑ Poisoning; Toxicology, Symptoms, Treatments, 2nd ed., Arena, J.M., Springfield, IL, C.C. Thomas, Vol. 2, Pg. 73, 1970.
- ↑ American Heart Journal. Vol. 84, Pg. 139, 1972.
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie, 91.–100. Auflage, de Gruyter, Berlin, 1985. ISBN 3-11-007511-3 (S. 928–931)
- ↑ „Phosphorverarmung: Bakterielle Säurebildner - Herrscher über Leben und Tod?“, Schattenblick 15.04.2008
- ↑ "The earth's available reserves of phosphate, which is the primary ingredient in fertilizers, could be exhausted within the next 50 to 130 years", in: A blooming waste, Website University of Technology, Sydney, 6. Nov. 2006 [1]; alternativ: "Depletion of current economically exploitable reserves are estimated at somewhere from 60 to 130 years. Using the median reserves estimates and under reasonable predictions, it appears that phosphate reserves would last for at least 100+ years"; in Arne Haarr, EUREAU (European Union of National Associations of Water Suppliers and Waste Water Services): The Reuse of Phosphorus [2]
- ↑ Phosphat bei USGS Mineral Resources
- ↑ M. Okrusch, S. Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7. Auflage, von Springer, 2005 ISBN 9783540238126
- ↑ FOCUS, Odenwalds Universum, 09. Mai 2008
- ↑ Medizinische Fakultät der Universität Rostock
- ↑ Stefan Lange, Peer Schmidt und Tom Nilges: Au3SnP7@Black Phosphorus: An Easy Access to Black Phosphorus. In: Inorg. Chem., 46 (10), 4028-4035, 2007. doi:10.1021/ic062192q
- ↑ a b c d G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 518-25.
- ↑ Arno Pfitzner, Michael F. Bräu, Josef Zweck, Gunther Brunklaus und Hellmut Eckert: Phosphorus Nanorods - Two Allotropic Modifications of a Long-Known Element in Angew. Chem. Int. Ed. 43 (2004), 4228 - 4231 doi:10.1002/anie.200460244
- ↑ E.-C. Koch Specials Materials in Pyrotechnics: IV. The Chemistry of Phosphorus and its Compounds, J. Pyrotech., 21, 2005, 39.[3]
- ↑ E.-C. Koch Specials Materials in Pyrotechnics: V. Military Applications of Phosphorus and its Compounds, Propellants Explos. Pyrotech, 33, 2008, 165.[4]
- ↑ Epstein 1972, 1994 (1)
- ↑ Taiz, Zeiger: Physiologie der Pflanzen (1998)
- ↑ Munitionsreste: Granaten in der Ostsee sueddeutsche.de: vom 09.01.2008
- ↑ Munitionsreste in der Ostsee. "Die Behörden zeigen kein Interesse" sueddeutsche.de, vom 08.01.2008
- ↑ Eintrag zu CAS-Nr. 12185-10-3 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 5. April 2008 (JavaScript erforderlich)
Literatur
- John Emsley: Phosphor – ein Element auf Leben und Tod. Weinheim 2001. ISBN 3-527-30421-5
- A. F. Holleman & Egon Wiberg: Lehrbuch der Anorganischen Chemie. Berlin 1995. ISBN 3-11-012641-9
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3
- F. Krafft: Phosphor. Von der Lichtmaterie zum chemischen Element. in: Angewandte Chemie 1969, 81 (17/18), S. 634–645.
- Erwin Riedel: Anorganische Chemie. Berlin 2002. ISBN 3-11-017439-1
Weblinks
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.

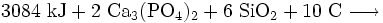
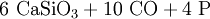




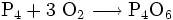
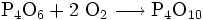





![\mathrm{H_2PO_4^- + 12 \ MoO_4^{2-} + 22 \ H^+ + 3 \ NH_4^+ \longrightarrow (NH_4)_3[P(Mo_3O_{10})_4]} + 12 \ H_2O](/pictures/dewiki/48/0840fb44e0196af26f2700f35db50ed9.png)
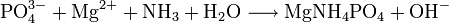
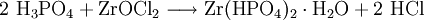
![\mathrm{H_2PO_4^- + 12 \ [MoO_2Cl_3(H_2O)]^- \longrightarrow [P(Mo_3O_{10})_4]^{3-} + 26 \ H^+ + 36 \ Cl^-}](/pictures/dewiki/97/a1f4795b2f5d2a5804a3729094b12df2.png)
![\mathrm{[P(Mo_3O_{10})_4]^{3-} + 3 \ HOx + 3 \ H^+ \longrightarrow (H_2Ox)_3[P(Mo_3O_{10})_4]}](/pictures/dewiki/57/9310e7bfc79ee325b23f7f0ad4bbe821.png)
![\mathrm{(H_2Ox)_3[P(Mo_3O_{10})_4] \cdot x \ H_2O}](/pictures/dewiki/54/66f9c83fefdd01e853418da6720d60ec.png)











