- Bakteriorhodopsin
-
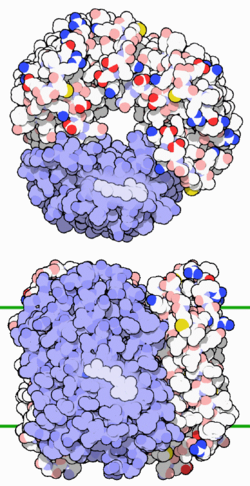
Bacteriorhodopsin Oberflächenmodell von oben und seitlich, ein eingebettetes Retinal-Molekül hervorgehoben, nach PDB 1FBB Vorhandene Strukturdaten: s. UniProt Größe 249 Aminosäuren Struktur Homotrimer; multipass Membranprotein Bezeichner Gen-Name(n) bop Externe IDs UniProt: P02945 Transporter-Klassifikation TCDB 3.E.1 Bezeichnung ionenverlagerndes mikrobielles Rhodopsin Vorkommen Homologie-Familie Bacteriorhodopsin Übergeordnetes Taxon Halobakterien Bacteriorhodopsin (BR) ist ein integrales Membranprotein, welches in der Zellmembran des extremophilen Organismus Halobacterium salinarum (Halobakterien) gefunden wird. Das Protein BR stellt den Lichtenergie-Konverter der photosynthetischen Energiegewinnung von Halobacterium salinarum dar. Die von Halobacterium salinarum vollzogene Photosynthese unterscheidet sich grundlegend von der Photosynthese der Pflanzen. Die Lichtenergie wird hier nicht zur Spaltung von Wasser genutzt, sondern dient über den Energiekonverter BR zum Aufbau eines Protonen-Konzentrationsunterschieds zwischen dem Innenraum (Cytoplasma) und Außenraum. Dieser Protonen-Konzentrationsunterschied stellt dann die Energiequelle für die ATP-Synthase dar. Aufgrund seiner außergewöhnlichen Funktionalität ist das Protein von großem wissenschaftlichem Interesse, zudem wurden für BR eine Reihe verschiedener technischer Anwendungen vorgeschlagen.
Inhaltsverzeichnis
Aufbau des Proteins
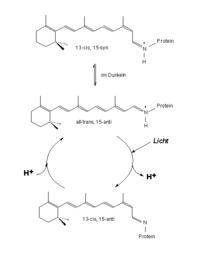
Das Protein des BR besteht aus 248 Aminosäuren die, in sieben näherungsweise parallelen alpha-Helices angeordnet, die Zellmembran durchziehen und eine Pore bilden. In dieser Pore befindet sich ein an das Protein gebundenes Retinalmolekül. Retinal stellt das Chromophor des Moleküls dar und ist über eine Iminbindung, in diesem Zusammenhang meist als Schiffsche Base bezeichnet, an die Aminfunktion der Aminosäure Lys216 gebunden. Unter physiologischen Bedingungen liegt das Chromophor nur als all-trans und 13-cis Isomer vor. Die Isomerisierung erfolgt unter Lichteinwirkung. BR bildet in der Zellmembran des Halobacterium salinarum, zusammengelagert zu Trimeren, zweidimensional kristalline Bereiche aus. Diese bis zu fünf Mikrometer großen Bereiche, in denen BR Trimere in zweidimensional hexagonaler Anordnung in der Lipiddoppelschicht vorliegen, heißen Purpurmembran (PM). Die Einbettung des BR in die Purpurmembran führt zu einer bemerkenswerten Stabilität des Proteins gegenüber physikalisch-chemischen Einflüssen. So bleiben Farbe und photochemische Aktivität der PM auch in Gegenwart von Sauerstoff, sowie im trockenen Zustand erhalten.
Funktion des Proteins
BR kann als molekulare Maschine betrachtet werden, welche, von Lichtenergie getrieben, Protonen pumpt. In einem mehrstufigen Prozess, initiiert durch die lichtinduzierte Isomerisierung des Chromophors und angetrieben durch Veränderungen der Protonenaffinitäten von Aminosäurefunktionen, werden Protonen von der cytoplasmatischen zur extracellulären Seite durch die Pore des Proteins verschoben. Auslösend für die gerichtete Protonenverschiebung ist die Isomerisierung des Retinal-Chromophors infolge von Lichtabsorption. Das Chromophor liegt im unbelichteten Zustand als Mischung von all-trans und 13-cis Retinal, nach Belichtung lediglich in der all-trans Konfiguration vor. Dies hat, aufgrund der Einbettung des Chromophors, strukturelle Veränderungen des Proteins zur Folge, was sich unmittelbar auf den zunächst protonierten Zustand der Schiffschen Base auswirkt. Dieses Proton befindet sich nach der Isomerisierung in einer energetisch ungünstigen Umgebung und wird an den unmittelbaren Wechselwirkungspartner der Schiffschen Base, Asp85, in extracelluläre Richtung abgegeben. Daran ist eine Folge von vier weiteren unidirektionalen Protonenverschiebungen geknüpft, bevor abschließend der Ausgangszustand des Proteins wiederhergestellt wird und ein neuer Zyklus durchlaufen werden kann. Dieses lichtgetriebene Pumpen von Protonen ist an eine zyklische Folge spektroskopisch unterscheidbarer Zustände des Proteins geknüpft. Diese Folge wird Photozyklus genannt. Das Durchlaufen des Photozyklus infolge von Belichtung ist mit einem reversiblen Farbwechsel von Purpur (B-Zustand, Absorptionsmaximum 570nm) nach Gelb (M-Zustand, Absorptionsmaximum 410nm) verbunden. [1]
Technische Anwendungen
Als Sicherheitsdruckpigment
Die erstmalige Anwendung von Bacteriorhodopsin erfolgte als photochromes Pigment in Sicherheitsdruckfarben [2].
Proteinspeicher mit 50 Terabyte Kapazität
Möglich wird dieser enorme Speicherplatz durch die Lichtempfindlichkeit des BR-Proteins, das auf der Membran eines Bakteriums gefunden wurde. Fällt Licht auf das BR-Protein, so verwandelt es sich in eine Reihe von unterschiedlichen Molekülen, wovon jedes Molekül eine einzigartige Form und Farbe aufweist, bevor es wieder in den Ausgangszustand zurückkehrt. Dieses Zwischenstadium dient der Gewinnung von chemischer Energie und hält in der Natur etwa eine Stunde an. Durch die Modifizierung der DNA des Bakteriums kann dieser Zustand mehrere Jahre lang aufrechterhalten werden. Umgelegt auf das binäre System der Computertechnik, bedeutet der Grundzustand eine 0 und der veränderte Zustand eine 1.
Literatur
- Jean-Baptiste Waldner: Nano-informatique et intelligence ambiante. Hermes Science Publications, London 2006, ISBN 978-2-7462-1516-0
Einzelnachweise
- ↑ Heiko Patzelt, Bernd Simon, Antonius terLaak, Brigitte Kessler, Ronald Kühne, Peter Schmieder, Dieter Oesterhelt, Hartmut Oschkinat: The structures of the active center in dark-adapted bacteriorhodopsin by solution state NMR spectroscopy. In: Proceedings of the National Academy of Sciences of the United States of America. Bd. 99, Nr. 15, 2002, S. 9765-9770
- ↑ Martin Neebe: Bakteriorhodopsin als multifunktionales photochromes Farbpigment für die Sicherheitstechnik. Dissertation Philipps-Universität Marburg 2003
Siehe auch
Wikimedia Foundation.