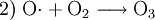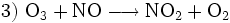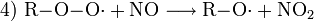- Ozonkreislauf
-
Strukturformel 
Allgemeines Name Ozon Andere Namen - „aktiver Sauerstoff“
- Trisauerstoff
Summenformel O3 CAS-Nummer 10028-15-6 Kurzbeschreibung farbloses[1] bis bläuliches[2] Gas mit unangenehm stechendem Geruch[1] Eigenschaften Molare Masse 48,00 g·mol−1 Aggregatzustand gasförmig
Dichte 2,14 kg·m−3 (0 °C)[1]
Schmelzpunkt Siedepunkt −110,5 °C[1]
Löslichkeit in Wasser: 494 ml·l−1 (0 °C)[3]
Sicherheitshinweise Gefahrstoffkennzeichnung nach „TRB 610 – Druckbehälter; Aufstellung von Druckbehältern zum Lagern von Gasen“[1] 


Brand-
förderndSehr giftig Ätzend (O) (T+) (C) R- und S-Sätze R: nicht festgelegt S: nicht festgelegt MAK nicht festgelegt, da krebserzeugend[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ozon (O3) (von griechisch ozein „riechen“) ist ein aus drei Sauerstoffatomen bestehendes Molekül. Spuren von Ozon-Gas in der Luft zerfallen unter Normalbedingungen innerhalb einiger Tage zu dimerem Sauerstoff. Einerseits ist es ein starkes Oxidationsmittel, wodurch es bei Menschen und Tieren zu Reizungen der Atemwege führen kann. Andererseits schützt das Gas in der Ozonschicht die Lebewesen vor der Schädigung durch energiereiche ultraviolette Strahlung der Sonne.
Inhaltsverzeichnis
Eigenschaften
Ozon ist bei Zimmertemperatur und normalem Luftdruck gasförmig. Aufgrund seiner oxidierenden Wirkung reizt es bei Menschen und Tieren die Atemwege. Bei Ozonaufnahme treten beim Betroffenen häufig heftige Schläfenkopfschmerzen auf. In hohen Konzentrationen riecht das Gas aufgrund der oxidierenden Wirkung auf die Nasenschleimhaut charakteristisch stechend-scharf bis chlorähnlich, während es in geringen Konzentrationen geruchlos ist. Die Geruchsschwelle liegt bei 40 µg/m3, allerdings gewöhnt man sich schnell an den Geruch und nimmt ihn dann nicht mehr wahr. Reines O3 ist eine allotrope Form von Disauerstoff O2. Bei Zimmertemperatur liegt es als instabiles, farbloses bis bläuliches, diamagnetisches Gas vor, das bei −110,5 °C zu einer tiefblauen Flüssigkeit[4] kondensiert und bei −192,5 °C (80 K) zu einem schwarzvioletten Feststoff[4] erstarrt. Das gewinkelte Molekül bleibt im Festkörper erhalten, der O-O-Abstand beträgt 128 Picometer, der Winkel zwischen den drei Sauerstoffatomen 117°. Ozon unterhält die Verbrennung sehr viel stärker als Disauerstoff, etliche Materialien flammen schon bei Raumtemperatur bei Kontakt auf. Gemische aus reinem Sauerstoff und Ozon ab 11,5 Vol%, können sich unter Atmosphärendruck bei entsprechend hoher Zündenergie explosionsartig zersetzen.[5]
Bildung
Ozon entsteht aus gewöhnlichem Sauerstoff gemäß der Grundgleichung[6]
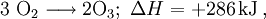
- wobei ΔH die molare Reaktionsenthalpie bezeichnet.
Ozon bildet sich in der Atmosphäre vor allem auf drei Arten:
- Energiereiche Sonnenstrahlung spaltet Sauerstoff-Moleküle in der Stratosphäre in zwei einzelne Atome, die sich jeweils mit einem weiteren Sauerstoff-Molekül zu Ozon vereinigen. Dieser Vorgang der Spaltung von Sauerstoff-Molekülen durch energiereiche UV-C-Strahlung mit einer Wellenlänge von < 0,242 µm wird als Photodissoziation bezeichnet.
- In Erdnähe bildet sich Ozon bei der Reaktion von Stickstoffdioxid NO2 mit Sauerstoff O2 unter dem Einfluss von UV-Strahlung.
- Bei Gewitter: Durch den elektrischen Stromfluss zwischen Wolke und Erdboden bei der Blitzentladung entsteht Ozon (neben Salpetersäure und weiteren Stoffen).
Vorkommen
Die Menge an Ozon in der Atmosphäre wird in Dobson-Einheiten (also pro Erdoberfläche) oder in ppm (also pro Stoffmenge Luft) angegeben. Die höchste Konzentration mit einigen ppm weist Ozon in der Stratosphäre auf. Für seine Entstehung ist dort der Ozon-Sauerstoff-Zyklus verantwortlich. Ozon ist in der Stratosphäre unschädlich und absorbiert teilweise die Ultraviolettstrahlung der Sonne. In der Atemluft ist es jedoch bereits in weit geringeren Konzentrationen gesundheitsschädlich, insbesondere bewirkt die lokal sehr unterschiedliche Ozonbelastung Reizungen der Atemwege.
In Reinluftgebieten ist die Ozon-Konzentrationen im Sommer oft höher als in Städten. Dies ist darauf zurückzuführen, dass durch die vielen Autoabgase in den Städten die Konzentration des Stickoxides NO sehr hoch sein kann. NO wirkt jedoch der Ozonbildung entgegen. Im einzelnen laufen folgende Reaktionen ab:
Ozon entsteht wie folgt:
Gleichzeitig wird Ozon durch NO wieder abgebaut:
Wären also nicht noch weitere Stoffe, sogenannte flüchtige Kohlenwasserstoffe oder auch CO, in der unteren Luftschicht vorhanden, würde sich kein weiteres Ozon bilden, sondern abhängig von der Sonneneinstrahlung stellt sich dann ein Gleichgewicht zwischen O3, NO und NO2 ein. Je stärker die Sonne scheint, desto mehr Ozon und weniger NO2 ist vorhanden, da letzteres ja durch die UV-Strahlung gespalten wird (Reaktion 1).
In der (verschmutzten) planetaren Grenzschicht der Atmosphäre finden sich aber, wie schon angedeutet, auch Kohlenwasserstoffe, die sowohl vom Menschen (anthropogen) also auch von der Vegetation (biogen) emittiert werden. Sie werden von OH-Radikalen, dem „Waschmittel der Atmosphäre“, oxidiert, wobei Peroxid-Radikale R-O-O· entstehen. Diese wiederum sorgen dafür, dass NO zu NO2 oxidiert wird, ohne dass dabei ein O3 „verbraucht“ wird wie in Reaktion 3, also:
Wenn danach wieder Reaktion 1 und 2 stattfinden, wird netto neues Ozon gebildet.
Da NO durch Autos und Industrie ausgestoßen wird, wird Ozon in der Stadt schneller wieder abgebaut (nach Reaktion 3) als in ländlichen Gegenden. Außerdem finden sich in ländlichen Gebieten häufig Kohlenwasserstoffe, die leichter von OH-Radikalen angegriffen werden können, wodurch Reaktion 4 schneller abläuft. Ein prominentes Beispiel für so einen leicht abbaubaren biogenen Kohlenwasserstoff ist Isopren. Die genaue Reaktionskette ist im Artikel Sommersmog beschrieben.
Die im Zusammenhang mit der Ozonschicht häufig erwähnten FCKW (Fluorchlorkohlenwasserstoffe) werden durch UV-Strahlung gespalten, wodurch freie Chlorradikale entstehen, die wiederum viele Ozon-Moleküle „zerstören“ können (siehe Ozonschicht).
Geschichte
Im Jahre 1839 beschrieb Christian Friedrich Schönbein zum ersten Mal die in der Chemie einzigartige Erscheinung, dass ein Element in Gasform in zwei verschiedenen molekularen Formen nebeneinander beständig ist – Ozon und Disauerstoff. Zunächst jedoch erschien diese Tatsache zu eigenartig, als dass die einfache Deutung Schönbeins, eine Allotropie im Gaszustand, allgemeine Anerkennung gefunden hätte.[7]
Die Abbaureaktionen von Ozon durch Stickoxide wurden 1970 erstmals von Paul Josef Crutzen (Nobelpreis für Chemie 1995) beschrieben.
Industrielle Verwendung
Darstellung im Labor
Ozon kann aus der Reaktion von Kaliumpermanganat mit konzentrierter Schwefelsäure gewonnen werden. Das als Zwischenprodukt entstehende instabile Dimanganheptoxid Mn2O7 zerfällt bei Raumtemperatur zu Mangandioxid und Sauerstoff, der reich an Ozon ist.
Bei der Elektrolyse verdünnter Schwefelsäure (ca. 20 %) entwickelt sich an einer Gold- oder Platinanode besonders bei hohen Stromdichten Ozon. Bei guter Kühlung lassen sich so 4–5 % Ozongehalt im entstehenden Sauerstoff erreichen, eine Konzentration, die ausreicht, um alle Reaktionen des Ozons im präparativen Maßstab ausführen zu können. Über ausgefeilte Apparaturen (z. B. feine Platindrahtwendeln) und Kühlung auf −14 °C lassen sich noch erheblich höhere Ozonkonzentrationen erreichen.
Ozon lässt sich weiterhin aus Luftsauerstoff unter Einwirkung von Ultraviolettstrahlung oder stillen elektrischen Entladungen herstellen. Entsprechende, als Ozonisatoren bezeichnete Geräte gibt es im Handel.[8]
Industrielle Herstellung
Aufgrund seiner Instabilität kann Ozon nicht über längere Zeit gelagert oder wie andere industriell verwendete Gase in Druckflaschen gekauft werden. Vor seiner Anwendung (chemische Synthese, Wasseraufbereitung, als Bleichmittel etc.) muss es an Ort und Stelle erzeugt werden.
Zur Herstellung wird meistens getrocknete Luft oder Sauerstoff (Taupunkt mind. −65 °C) als Trägergas eingesetzt. In selteneren Fällen wird Sauerstoff mit Argon, Kohlenstoffdioxid u. ä. gemischt. Im Ozonerzeuger werden die Sauerstoffmoleküle durch stille elektrische Entladung zu Sauerstoffatomen dissoziiert, wonach noch im Plasma der Entladungsfilamente die Ozonsynthese und Ozonanreicherung stattfindet. In Luft bewegen sich typische Endkonzentrationen zwischen einem und fünf Gewichtsprozent, in Sauerstoff zwischen sechs und dreizehn Gewichtsprozent.
Die in der Praxis eingesetzten technischen Vorrichtungen können auf folgenden Elektrodenkonfigurationen basieren:
- ineinander geschobene Rohre (z. B. metallisch innenbeschichtetes Glasrohr im Stahlrohr)
- parallele Platten
- drahtumwickelte Elektroden für Oberflächenentladungen
- Spitze zu Platte
Bei Anlagen mit mehr als 20 kg Ozon pro Stunde werden üblicherweise nur Röhrenozonisatoren eingesetzt.
In erster Näherung ist die Ozonanreicherung eine Funktion des elektrischen Energieeintrags pro Gasvolumen. Zur Optimierung des Wirkungsgrades können folgende Parameter variiert werden:
- Elektrodenabstand
- Elektrodenausrichtung
- Dielektrikumsmaterial
- Spitzenspannung und Frequenz
Obwohl die Ozonbildung aus Sauerstoff unter Wärmeabsorption erfolgt, sind Ozonerzeugerkessel In industriellen Anwendungen wassergekühlt, da fast 90 Prozent der eingetragenen Energie infolge der hohen Zersetzungsrate wieder abgeführt werden müssen. Für den Wirkungsgrad der Ozonsynthese ist die Gastemperatur ein weiterer dominierender Faktor.
Ferner kann durch Zentrifugation während des Energieeintrags, das chemische Gleichgewicht, welches sich aus Synthese und Zersetzung bei wenigen Gewichtsprozent einstellt, zugunsten des Ozons verschoben werden.
Wegen der hohen Reaktivität von Ozon sind nur wenige Materialien gegen Ozon beständig. Dazu gehören rostfreier Stahl (Qualität 316L), Glas, Polytetrafluorethylen, Polyvinylidenfluorid und Perfluorkautschuk. Bedingt beständig ist Viton, das unter Ozon keiner mechanischen Wechselbelastung ausgesetzt werden darf.
Lagerung
Flüssiges Ozon lässt sich in Form einer 30 bis 75 %igen Lösung in flüssigem Sauerstoff bei –183 °C in Gegenwart von Stabilisatoren wie CClF3, OF2, SF6 oder andere ohne Explosionsgefahr lagern. Gasförmiges Ozon lässt sich im reinen Zustand (keine Verunreinigungen durch organische Verbindungen, Schwefel oder bestimmte Metalle) bei –50 bis –112 °C bei leichtem Überdruck recht gut lagern.
Ozon in der Wasseraufbereitung
Bei der Wasseraufbereitung dient Ozon unter anderem zur umweltfreundlichen Oxidation von Eisen, Mangan, organischer Substanz und zur Entkeimung. So gehört eine Ozonierung in vielen Trinkwasserwerken zu den zentralen Aufbereitungsstufen (siehe Weblinks).
Siehe auch: Wasseraufbereitung im Schwimmbad
Auch in der Behandlung von kommunalen und industriellen Abwässern kommt Ozon zum Einsatz (Kläranlage). Die Ozonierung wird dabei der üblichen Abwasserreinigung durch Mikroorganismen zusätzlich nachgeschaltet. Allerdings handelt es sich bei Kläranlagen mit Ozonanlagen meist um Pilotprojekte (wie zum Beispiel in Regensdorf-Watt in der Schweiz), denn die Produktion von Ozon in solch großen Maßstäben ist teuer, energieaufwändig und die Schutzmaßnahmen gegen den giftigen und ätzenden Stoff sind erheblich. Zurzeit wird diskutiert, ob die Abwasserreinigung durch die ungiftige Aktivkohle nicht ungefährlicher, billiger und umweltfreundlicher wäre. Ziele einer weitergehenden Ozonbehandlung des konventionell gereinigten Abwassers sind: (a) Abtötung pathogener Keime (Desinfektion) zur Sicherung des Vorfluters (z. B. in Hinsicht auf die Badegewässerrichtlinie) (b) oxidative Elimination / Transformation von nicht oder nur schlecht abbaubaren organischen Spurenstoffen (insbesondere Medikamentenrückstände).
Ein Nachteil der Ozonierung ist die Entstehung von unbekannten und möglicherweise giftigen Produkten, wenn Ozon mit Schadstoffen im Wasser reagiert. So wird die Bildung von krebserregenden Nitrosaminen vermutet. Des Weiteren werden einige Schadstoffe, zum Beispiel iodhaltige Röntgenkontrastmittel, von Ozon praktisch nicht abgebaut. Sie gelangen deshalb weiterhin in die Umwelt.
Ozon kann sehr gut in Verfahrenskombinationen mit nachfolgenden biologischen Systemen (Biofilter) eingesetzt werden, so beispielsweise bei der Oxidation des chemischen Sauerstoffbedarfs (CSB) zum biologischen Sauerstoffbedarf (BSB), der dann im Biofilter weiterverarbeitet wird. Ebenso findet Ozon in Fischkreisläufen in der Aquakultur oder Aquariensystemen Anwendung.
Bei den meisten „chlorfrei“ benannten Produkten oder Verfahren wird Ozon eingesetzt, so zum Beispiel beim Bleichen von Papier. In diesem Zusammenhang ist oft von „aktivem Sauerstoff“ die Rede.
Ozonbehandlung von Fahrzeugen
Eine sogenannte Ozonbehandlung wird in der professionellen Fahrzeugaufbereitung vorgenommen. Insbesondere bei Gebrauchtwagen mit Geruchsbelästigung im Innenraum kann diese so beseitigt werden. Der Fahrzeuginnenraum wird dabei vollkommen abgedichtet und ca. 24 Stunden mit Ozon geflutet. Durch die oxidierende Wirkung des Ozons werden Geruchstoffe in geruchsneutrale Stoffe umgewandelt. Ebenso werden Keime und geruchverursachende Bakterien dabei auch an sonst unzugänglichen Stellen zuverlässig abgetötet. Als Ergebnis ist das Fahrzeug nach dieser Behandlung desinfiziert und in der Regel geruchsfrei.
Analyse
- Titriermethode
- UV-Analyse
- Entropiemethode
Trivia
Bei älteren Fotokopierern sowie Laserdruckern kann man einen typischen „Ozongeruch“ wahrnehmen. Dieser Geruch rührt nur indirekt vom durch die Ionisation der Luft im Gerät gebildeten Ozon her; er kommt vielmehr durch Spuren nitroser Gase (NOx) zustande, die durch Reaktion des Ozons mit dem Luftstickstoff gebildet werden. Das Funktionsprinzip der Geräte erfordert eine Ionisierung der Luft bei Spannungen von 5–15 kV. Meist besitzen die Geräte Ozonfilter, die das produzierte Ozon in Kohlendioxid umwandeln. Dennoch sollten diese Geräte möglichst nicht in unbelüfteten Räumen verwendet werden. Moderne Drucker und Fotokopierer arbeiten mit einer Transferrollentechnik, welche die Ozonbildung verhindert und die ältere Coronadrahttechnologie weitestgehend ersetzt hat.
Gesundheitsgefährdung
Die EU hat schon seit längerer Zeit Richtwerte für die Ozonkonzentration festgelegt. Keine Gefahr für die Gesundheit besteht laut EU-Richtlinie durch Ozon unter einem Gehalt von 110 µg/m3. Ab einem Ein-Stunden-Mittelwert von 180 µg/m3 erfolgt die Unterrichtung der Bevölkerung, da bei dieser Konzentration die Leistungsfähigkeit empfindlicher Menschen bereits beeinträchtigt werden kann. Ab ungefähr 200 µg/m3 Ozon können Symptome wie Tränenreiz, Schleimhautreizungen in Rachen, Hals und Bronchien, Kopfschmerzen, verstärkter Hustenreiz, Verschlechterung der Lungenfunktion auftreten. Ab einem Ein-Stunden-Mittelwert von 360 µg/m3 werden Warnungen ausgesprochen, da ab dieser Konzentration Gefahr für die menschliche Gesundheit bestehen kann. In der Schweiz liegt der Ein-Stunden-Mittelwert bei 120 µg/m3 (60 ppb). Dieser Wert wird jedoch sehr oft überschritten.[9][10]
Quellen
- ↑ a b c d e f g Eintrag zu Ozon in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 10. Feb. 2008 (JavaScript erforderlich)
- ↑ Schröter, W., Lautenschläger, K.-H. und Bibrack, H.: Chemie. Fakten und Gesetze. (16. Auflage) Fachbuchverlag Leipzig GmbH, (Lizenzauflage für den Verlag Buch und Zeit, Köln), 1992, ISBN 3-8166-0190-1 Seite 226.
- ↑ Holleman, Wiberg; Lehrbuch der Anorganischen Chemie, de Gruyter, 91.–100. Auflage, 1985, S. 460
- ↑ a b Christen, Meyer: Grundlagen der allgemeinen und anorganischen Chemie. Diesterweg, 1997, ISBN 978-3793554936
- ↑ http://www.iitk.ac.in/che/jpg/papersb/full%20papers/K-106.pdf
- ↑ Ozone in the Atmosphere (abgerufen am 17. Mai 2008)
- ↑ http://resources.metapress.com/pdf-preview.axd?code=k524537k84082227&size=largest
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 337–40.
- ↑ Amt für Lebensmittelkontrolle und Umweltschutz des Kantons Schaffhausen: Die gesundheitliche Bedeutung der Ozongehalte in der Luft, Merkblatt Juni 2001 (pdf)
- ↑ Bundesverwaltung admin.ch Statistik Schweiz: Luftqualität, in: Umwelt Schweiz 2007, Kap. 7 (pdf, 385 kB)
Literatur
- Katrin Palitzsch, Sabine Göllner, Kristina Lupa, Jörg Matschullat, Corinna Messal, Kirsten Pleßow, Mandy Schipek, Ivonne Schnabel, Christian Weller, Frank Zimmermann: Ozon in Waldökosystemen aus atmosphärenchemischer und pflanzenphysiologischer Sicht. Umweltwissenschaften und Schadstoff-Forschung 17(4), S. 231 - 241 (2005), ISSN 0934-3504
- Georg Erlwein: Über Trinkwasserreinigung durch Ozon und Ozonwasserwerke. Leineweber, Leipzig 1904 (Digitalisat als PDF)
Siehe auch
Weblinks
- Umweltbundesamt Aktuelle Immissionsdaten aus den Messnetzen der Bundesländer und des UBA
- Luftreinhaltung Rheinland-Pfalz Das Luftmessnetz ZIMEN Rheinland-Pfalz
- Thomas Seilnachts didaktische Medien Ozon und Ozonloch
- [1] Meyers Konversationslexikon Vierte Auflage, 1885-1892
- www.ozon-info.ch „Ozon schadet!“
- Ozon (Uni-Bielefeld)
- Ozon als Gefahrstoff im ICSC
- Ozonseite von Ernst-Georg Beck
- Aktuelle Informationen über Ozon - Ozonwerte, etc. (Umweltbundesamt)
- Wissensquiz zu Ozon und Sommersmog (E-learning Plattform)
Wikimedia Foundation.