- Ni-Cd-Akku
-
Nickel-Cadmium-Akku der PSA Peugeot Citroën, Kapazität 100 Ah, 120 Volt, 300 kg; Bordladegerät max. 3 kW entspricht Zugewinn 15 km Reichweite je Stunde; für Peugeot 106 Electrique, Citroën Saxo Electrique (die beiden meistverkauften), Citroën AX Electrique und die Transporter Citroën Berlingo Electrique und Peugeot Partner Electrique. Insgesamt wurden über 10.000 Exemplare des sehr langlebigen und kältefesten Nickel-Cadmium-Akkus bis zum Verbot verbaut.Der damit betriebene Elektroantriebssatz von PSA Peugeot Citroën. Aufgenommen im Museum Autovision, Altlußheim Deutschland.
Ein Nickel-Cadmium-Akkumulator (NiCd-Akku) ist ein wiederaufladbarer Akkumulator (so genannte Sekundärzelle).
Von der grundsätzlichen Bauart ist zwischen offenen und gasdichten Zellen zu unterscheiden. Gasdichte Zellen sind häufig baugleich zu handelsüblichen Batterien und können daher als Ersatz für diese sogenannten Primärzellen verwendet werden, offene Zellen werden für stationäre Anwendungen verwendet.
Inhaltsverzeichnis
Geschichte
Der Nickel-Cadmium-Akkumulator wurde 1899 von dem Schweden Waldemar Jungner entwickelt. Der NiCd-Akkumulator gehört zu den alkalischen Batteriesystemen, an denen auch Thomas Alva Edison zu der Zeit parallel gearbeitet hat. Ein wesentlicher Unterschied zu dem bis dahin bekannten Bleiakkumulator ist, dass das Elektrolyt während der Ladung und Entladung unverändert bleibt.
1910 begann die industrielle Fertigung des NiCd-Akkumulators in Schweden. Diese ersten NiCd-Akkumulatoren hatten sogenannte Taschenelektroden, die auch heute noch üblich sind. Ungefähr 1930 wurden in Deutschland sogenannte Sinterelektroden entwickelt. Das Prinzip der gasdichten Zellen wurde 1933 von Dassler veröffentlicht. Serienreife gasdichte Zellen waren in den 50er Jahren verfügbar. Bis in die 1990er Jahre hat sich der NiCd-Akkumulator zu der meistgebräuchlichen wiederaufladbaren Batterie im Endverbraucherbereich entwickelt. Zukünftig werden Nickel-Metallhydrid-Akkus (NiMH) und Lithium-Systeme mehr Bedeutung bekommen, da sie höhere Energiedichten aufweisen und keine umweltschädlichen Schwermetalle wie Cadmium enthalten.
EU-weites Verbot
Im Dezember 2004 hat der EU-Ministerrat eine Richtlinie verabschiedet, deren Ziel es ist, die technische Nutzung von Cadmium zu reduzieren. Vorbehaltlich der Zustimmung des EU-Parlaments sollen die Mitgliedsstaaten innerhalb von zwei Jahren durch nationale Gesetze zunächst Nickel-Cadmium-Akkus verbieten. Auf Wunsch einiger Mitgliedsstaaten – darunter auch Deutschland – sollen jedoch, unter anderem schnurlose Elektrowerkzeuge, so genannte Power Tools, von dem Verbot zunächst ausgenommen werden, weil „für Power Tools nicht sichergestellt ist, dass gleichwertiger Ersatz aktuell verfügbar ist“. Vier Jahre nach Inkrafttreten der Richtlinie soll diese Ausnahme jedoch überprüft werden, um das Cadmium-Verbot dann möglicherweise auszudehnen. Siehe auch RoHS.
Alle Mitgliedsstaaten der EU wurden verpflichtet, diese Richtlinie in nationales Recht umzusetzen.
2006 hat das Europäische Parlament eine veränderte Version der Richtlinie angenommen, die Batterien und Akkumulatoren mit mehr als 0,002 Gewichtsprozent Cadmium verbietet.[1]
Eigenschaften
NiCd-Akkumulatoren haben eine nominale Spannung von 1,2 Volt, die somit 20 % unter den 1,5 Volt normaler Batterien liegt. Dies stellt jedoch kein Problem dar, da die meisten Geräte auf niedrige Spannungen von 0,9–1,0 Volt entladener Batterien ausgelegt sind. Durch den geringen Innenwiderstand von NiCd-Akkumulatoren können diese hohe Ströme liefern. NiCd-Akkus werden (auch deshalb) vor allem im Modellbau und bei anderen Hochstromanwendungen genutzt. NiCd-Akkus müssen bei einer Restspannung (Entladeschlussspannung) von 0,85 - 0,9 Volt wieder aufgeladen werden, eine weitergehende Entladung führt zu Tiefentladung, die in ihren Auswirkungen mit dem (bei mit modernen Ladegeräten aufgeladenen, handelsüblichen NiCd-Akkus kaum vorhandenen) Memory-Effekt verwechselt wird.
Eine bei anderen Technologien selten anzutreffende Eigenschaft ist das hervorragende Tieftemperaturverhalten von NiCd-Akkumulatoren. Selbst bei –40 °C besitzt ein Akku mit Faserstrukturplatten-Technik noch über 50 % seiner nominellen Kapazität bei Raumtemperatur.
Aufbau
Die Elektroden des NiCd-Akkumulators bestehen in geladenem Zustand aus Platten, die am Minuspol mit fein verteiltem Cadmium und am Pluspol mit Nickel(III)-oxidhydroxid beladen sind. Als Elektrolyt wird 20-prozentige Kaliumhydroxid-Lösung verwendet. Diese Kombination liefert eine Spannung von 1,3 V.
Den Elektrodenmaterialien wird zusätzlich Graphitpulver zugegeben, um ihre Leitfähigkeit zu verbessern. Darüber hinaus werden die Elektroden von Metallen umschlossen, die elektrischen Strom gut leiten, bei den Reaktionen beim Laden und Entladen jedoch nicht stören und auch selbst nicht reagieren.
Bei Überladung des Akkumulators wird an der negativen Elektrode Wasserstoff und an der positiven Elektrode Sauerstoff produziert; man sagt der Akku „gast“. In geschlossenen, also gasdichten Zellen muss dies wegen der Explosionsgefahr unbedingt verhindert werden. Aus diesem Grund wird die negative Cadmiumelektrode überdimensioniert und dient als negative Entladereserve. Die positive Nickelelektrode enthält etwas Cadmiumhydroxid als „antipolare Masse“. Bei Überladung mit geringeren Laderaten (ca. 0,1 C), stellt sich so ein Gleichgewicht zwischen Sauerstofffreisetzung und -verbrauch ein, es wird kein Wasserstoff entwickelt.
In gasdichten Faserstruktur-NiCd-Zellen wird der entstehende Sauerstoff an einer katalytisch wirksamen Oberfläche der Faserstruktur-Rekombinationselektrode so schnell rekombiniert, dass im Betrieb sogar ein leichter Unterdruck entsteht.
Aufladung
Siehe Ladeverfahren.
Elektrochemie
NiCd-Akkumulatoren enthalten im geladenen Zustand:
- eine positive Elektrode: NiO(OH)
- eine negative Elektrode: Cd
- einen Separator
- ein Elektrolyt, meist 20-prozentige KOH
Entladevorgang: An der Anode / negativen Elektrode wird Cadmium zum Cadmiumhydroxid (Cd(OH)2) oxidiert. Die freiwerdenden Elektronen fließen dann über den Verbraucher zur Kathode / positiven Elektrode. Dort wird das Nickel(III)-oxidhydroxid NiOOH zu Nickel(II)-hydroxid Ni(OH)2 reduziert.
Standardelektrodenpotentiale: E(Cd/Cd2+) = -0,81 V (in basischer Lösung); E(NiO(OH)/Ni(OH)2)= +0,49 V
Reaktionen:
-
Negative Elektrode: 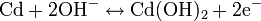
Positive Elektrode: 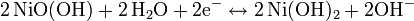
Gesamtreaktion: 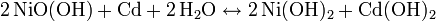
 : Entladung
: Entladung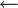 : Ladung
: Ladung
Ladevorgang: Die Reaktionen laufen in umgekehrter Richtung ab, die Cadmium-Elektrode ist dann ebenfalls Minuspol, aber Kathode, da hier reduziert wird, die Nickelelektrode ist entsprechend Pluspol / Anode, an dem eine Oxidation abläuft.
Überladen: Gegen Ende des Ladezyklus steigt die Zellspannung an, ab etwa 1,55 bis 1,6 V wird die Zersetzungsspannung des Wassers unter den Bedingungen der Zelle überschritten, es kommt zum Gasen:
Negative Elektrode: 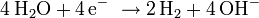
Positive Elektrode: 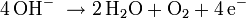
Gesamtreaktion: 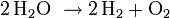
In gasdichten NiCd-Akkus wird ein Überschuss von Cadmium(II)-hydroxid verwendet. Am Pluspol entsteht beim Überladen Sauerstoff, während am Minuspol noch Cd2+ reduziert wird. Der Sauerstoff reagiert dann mit Cadmium weiter zu Cadmium(II)-hydroxid und wird so gleich wieder verbraucht.
Probleme
NiCd-Akkus enthalten das giftige Schwermetall Cadmium und müssen daher über besondere Rücknahmesysteme gesondert entsorgt werden (siehe Abschnitt Entsorgung).
Beim Überladen können NiCd-Akkumulatoren beschädigt werden:
- Ausgasen durch Überhitzung/Überladung (irreversibel)
- Entstehen von γ-NiOOH und dadurch Spannungsabfall (44–50 mV)
- Entstehen von intermetallischer Verbindung Ni5Cd21 und dadurch Spannungsabfall (120 mV)
Auch Falschladung (Verpolen) beschädigt eine Zelle durch Ausgasen an der Anode. Dadurch entsteht auch hochentzündlicher Wasserstoff. Die Falschpolung einer Zelle innerhalb eines Akkupacks tritt bereits bei Tiefentladung auf. Die Zellen sind in Reihe geschaltet. Wenn die schwächste Zelle entladen ist, liegt an ihrer negativen Elektrode der Pluspol, an der positiven Elektrode der Minuspol der Nachbarzellen.
Vorteile
Im Gegensatz zu NiMh- und Lithium-basierten Akkumulatoren zeichnen sich NiCd-Zellen vor allem durch eine deutlich höhere Robustheit gegen Tiefentladung und Überladung aus. So kann in einer Batterie aus reihengeschalteten NiCd-Akkumulatoren ein einheitlicher Ladezustand erreicht werden, indem diese gezielt mit geringem Strom (1/10 der Kapazität) überladen wird. Zellen mit einem bereits hohen Ladestand wandeln die zugeführte Energie bei hinreichend niedrigen Strömen in Wärme um, ohne dabei irreversible Schäden zu erleiden. Dieses Verfahren ist bei anderen Akkutypen nicht oder nur eingeschränkt möglich, sodass es hier wesentlich häufiger zu Schäden durch ungleichmäßigen Ladezustand der Zellen (und daraus folgende Überladung bzw. Tiefentladung) kommt. Weiterhin besitzen NiCd-Zellen bis heute unerreicht günstige Eigenschaften beim Einsatz bei niedriger Umgebungstemperatur.
Beide Eigenschaften sind insbesondere bei vielen sicherheitskritischen Anwendungen von großer Bedeutung, so dass hier in vielen Fällen Lithium- oder NiMh-Akkumulatoren keinen geeigneten Ersatz darstellen.
Entsorgung
Siehe Hauptartikel: Batterierecycling
Da NiCd-Akkus das giftige Schwermetall Cadmium enthalten, dürfen sie nicht über den Hausmüll entsorgt werden. Es gibt für sie besondere Rücknahmesysteme, in Deutschland etwa betrieben durch die Stiftung Gemeinsames Rücknahmesystem Batterien.
NiCd-Akkus lassen sich bei ordnungsgemäßer Entsorgung gut wiederverwerten. Das Cadmium kann durch Destillation zurückgewonnen werden, da es einen wesentlich niedrigeren Siedepunkt als die anderen Bestandteile des Akkus (in der Regel Nickel und Stahl) hat[2].
Anwendung
Offene Zellen
- Unterbrechungsfreie Stromversorgung (USV) (Notstromversorgung)
- Zentrale Stromversorgungssysteme für Notbeleuchtung
- Verwendung in Luftfahrzeugen als Starterbatterie und Notstromversorgung
- Verwendung bei Grubenlampen
Gasdichte Zellen
- Verbraucherbereich allgemein (Spielzeug, Fotoapparate, Elektrische Werkzeuge, Fernbedienungen usw.)
- Notbeleuchtung Einzelbatterieleuchten
Siehe auch
Literatur
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren - Mobile Energiequellen für heute und morgen. Springer, Berlin 1998 ISBN 3-540-62997-1
- David Linden, Thomas B. Reddy (Hrsg.): Handbook of Batteries. 3. Auflage. McGraw-Hill, New York 2002 ISBN 0-071-35978-8
- Andreas Jossen, Wolfgang Weydanz: Moderne Akkumulatoren richtig einsetzen, Printyourbook 2006, ISBN 9783939359111
Weblinks
Referenzen
- ↑ Pressemeldung des Europäischen Parlaments
- ↑ Erläuterung zum Recycling von Batterien auf den Seiten der GRS (Stand 2007-09-17).
Primärzellen: Alkali-Mangan-Batterie | Daniell-Element | Leclanché-Element | Lithium-Batterie | Lithium-Eisensulfid-Batterie | Nickel-Oxyhydroxid-Batterie | Quecksilberoxid-Zink-Batterie | Silberoxid-Zink-Batterie | Zink-Braunstein-Zelle | Zinkchlorid-Batterie | Zink-Luft-Batterie
Sekundärzellen: Bleiakkumulator | Natrium-Schwefel-Akkumulator | Nickel-Cadmium-Akkumulator | Nickel-Eisen-Akkumulator | Nickel-Metallhydrid-Akkumulator | Nickel-Wasserstoff-Akkumulator | Lithium-Eisen-Phosphat-Akkumulator | Lithium-Ionen-Akkumulator | Lithium-Mangan-Akkumulator | Lithium-Polymer-Akkumulator | Lithium-Titanat-Akkumulator | Vanadium-Redox-Akkumulator
Ausführungen: Akkumulator | Batterie | Brennstoffzelle | Konzentrationselement | Redox-Flow-Zelle | Bestandteile: Halbzelle (Donator- und Akzeptorhalbzelle)
Wikimedia Foundation.





